
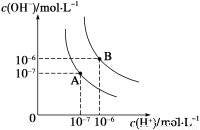
(1)水的电离平衡曲线如图所示,若A点、B点分别表示25 ℃和100 ℃时水的电离达平衡时的离子浓度。则表示25 ℃的是___________(填“A”或“B”)。100 ℃时,在1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=__________mol·L-1。100 ℃时,5×10-5 mol·L-1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为 。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的NaHCO3溶液、NaCN溶液、Na2CO3溶液、CH3COONa溶液,四种溶液的pH由大到小的顺序为_________________________。
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的离子方程式为_______________________。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl?,利用Ag+与CrO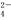 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl?恰好完全沉淀(浓度等于1.0×10?5 mol·L?1)时,溶液中c(Ag+)为___________mol·L?1,此时溶液中c(CrO
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl?恰好完全沉淀(浓度等于1.0×10?5 mol·L?1)时,溶液中c(Ag+)为___________mol·L?1,此时溶液中c(CrO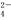 )等于__________ mol·L?1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10?12和2.0×10?10)。
)等于__________ mol·L?1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10?12和2.0×10?10)。
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源:2017届内蒙古高三上9月月考化学卷(解析版) 题型:选择题
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
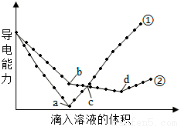
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源:2017届江苏省无锡市三校联合体高三上第一次月考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.明矾溶液中滴加过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH
B.醋酸溶液与Mg(OH)2反应:Mg(OH)2+2H+===Mg2++2H2O
C.小苏打溶液中加足量澄清石灰水:2HCO +Ca2++2OH-===CaCO3↓+2H2O+CO
+Ca2++2OH-===CaCO3↓+2H2O+CO
D.SO2通入FeCl3溶液中:SO2+Fe3++2H2O===SO +Fe2++4H+
+Fe2++4H+
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
某溶液中含有NH4+、Mg2+、Fe2+、Al3+、SO42-五种离子,若向其中加入过量的氢氧化钡溶液,微热并搅拌,再加入过量的氢碘酸,溶液中大量减少的离子有( )
A.1 种 B.2 种 C.3 种 D.4 种
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来冶炼倭铅(即锌),其原理如图2。已知锌的熔点420℃、沸点906℃。则下列说法错误的是( )

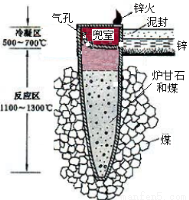
图1 图2
A.“泥封”的目的是为了防止得到的锌被氧化
B.“锌火”是锌蒸气和一氧化碳在空气的燃烧
C.冶炼时锌变为蒸气在兜室冷凝为固体
D.升炼倭铅过程包含分解反应和氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2017届四川省校高三上学期第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.0.2 mol Na2O2和Na2S的混合物中共含有离子数目为0.6 NA
B.1 mol Cl2溶于水的过程中有NA个电子转移
C.常温下,pH=12的氢氧化钠溶液中OH—数目为0.01 NA
D.1.0 mol/L FeCl3溶液全部转化成氢氧化铁胶体所得胶粒数目为NA
查看答案和解析>>
科目:高中化学 来源:2017届湖南省实验班高三上第一次质检化学试卷(解析版) 题型:选择题
工业上,可用硫酸铈[Ce(SO4)2]溶液吸收尾气中NO,其化学方程式如下:2NO+3H2O+4Ce(SO4)2=2Ce2(SO4)3+HNO3+HNO2+2H2SO4 ,下列说法正确的是
A.在该反应中氧化剂与还原剂的物质的量之比为1∶2
B.在该反应中,氧化产物有两种,还原产物有一种
C.若不考虑溶液体积变化,吸收尾气后,溶液的pH将增大
D.在该反应中,每消耗22.4LNO必转移2 mol电子
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.已知电离常数H2SO3 K1=1.3×10-2 K2=6.3×10-8;H2CO3 K1=4.2×10-7 K2=5.6×10-11。
H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-=SO32-+2CO2↑+2H2O
B.控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:
2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
C.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液。当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S=PbS↓+2H+
D.CuSO4溶液与过量浓氨水反应:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:实验题
如图装置进行SO2气体性质实验。
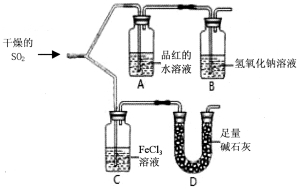
请回答:
(1)仪器D的名称是 。
(2)实验过程中,仪器A中的实验现象是 。
(3)写出仪器C中发生氧化还原反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com