
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
分析 (1)①分析图表数据,结合影响平衡因素和平衡移动原理分析,利用“定一议二”的方法分析温度一定,平衡体系中CH3OCH3(g)的物质的量分数随压强变化,反应是气体体积减小的反应,增大压强平衡正向进行,平衡体系中CH3OCH3(g)的物质的量分数增大;反应是放热反应,温度越高,平衡逆向进行,平衡体系中CH3OCH3(g)的物质的量分数减小;平衡常数随温度变化;依据化学平衡三段式列式计算转化率=$\frac{消耗量}{起始量}$;
②平衡一定向正反应方向移动,利用反应是气体体积减小的放热反应,增大压强、降低温度、减少生成物促进平衡正向进行;
(2)碳酸氢钾溶液中碳酸氢根离子水解显碱性,变式比值同乘以氢离子浓度,结合电离平衡常数和溶液中离子积常数分析判断,用碳酸钾溶液吸收空气中CO2,
a、当溶渡呈中性时溶液中存在电荷守恒分析;
b、中性溶液中存在碳酸氢根离子和碳酸溶液分析判断;
c、溶液中离子积随温度变化;
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,碳酸根离子和铁离子发生双水解反应生成氢氧化铁胶体和二氧化碳.
解答 解:(1)①2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=-122.4kJ•mol-1,反应是气体体积减小的反应,增大压强平衡正向进行,平衡体系中CH3OCH3(g)的物质的量分数增大,P1、P2、P3分析数值变化可知,平衡体系中CH3OCH3(g)的物质的量分数减小,说明平衡逆向进行,压强减小P1>P3,反应是放热反应,温度越高,平衡逆向进行,平衡体系中CH3OCH3(g)的物质的量分数减小,平衡常数随温度变化,若T1、Pl,T3、P3时平衡常数分别为K1、K3,依据数据分析,T1>T3,K1<K3;
依据化学平衡三段式列式计算T1、Pl时H2的平衡转化率,设氢气转化率为x;
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)
起始量(mol) 2 6 0 0
变化量(mol) $\frac{1}{3}$x x $\frac{1}{6}$x $\frac{1}{2}$x
平衡量(mol)2-$\frac{1}{3}$x 6-x $\frac{1}{6}$ x $\frac{1}{2}$x
甲醚物质的量分数=$\frac{\frac{1}{6}x}{2-\frac{1}{3}x+6-x+\frac{1}{6}x+\frac{1}{2}x}$×100%=0.10
x=$\frac{24}{7}$mol
转化率=$\frac{消耗量}{起始量}$$\frac{\frac{24}{7}mol}{6mol}$=×100%=57.14%;
故答案为:<;>;57.14%;
②平衡一定向正反应方向移动,利用反应是气体体积减小的放热反应,增大压强、降低温度、减少生成物促进平衡正向进行;
a.反应物的浓度降低,平衡逆向进行,故a不符合;
b.容器内压强增大,平衡向气体体积减小的方向进行,即正反应方向进行,若恒温恒容容器中加入惰气,压强增大,平衡不动,故b不符合;
c.正反应速率大于逆反应速率,反应一定正向进行,故c符合;
d.化学平衡常数K增大,说明反应正向进行,故d符合;
故选cd;
(2)碳酸氢钾溶液中碳酸氢根离子水解显碱性,HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,变式比值同乘以氢离子浓度得到$\frac{c(HC{{O}_{3}}^{-})c({H}^{+})}{c(C{{O}_{3}}^{2-})c({H}^{+})}$=$\frac{c({H}^{+})}{Ka}$,溶液呈碱性,加入水稀释,氢氧根离子浓度减小,依据离子积常数可知,溶液中氢离子浓度增大,比值增大;
a、当溶渡呈中性时溶液中存在电荷守恒分析,溶液中存在物料守恒为:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),得到c(K+)=2c(CO32-)+c(HCO3-),故a错误;
b、中性溶液中存在碳酸氢根离子和碳酸溶液,溶液中碳酸电离生成碳酸氢根离子和氢离子,碳酸氢根离子发生微弱的水解,溶液中存在c(HCO3-)>c(CO32-),故b正确;
c、溶液中离子积随温度变化,降低温度,离子积发生变化,故c错误;
故选b;
故答案为:增大;b;
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,碳酸根离子和铁离子发生双水解反应生成氢氧化铁胶体和二氧化碳,反应的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑,
故答案为:2Fe3++3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑.
点评 本题考查了化学平衡、平衡常数影响因素分析判断,概念的计算应用,电解质溶液中离子浓度大小比较,电离平衡常数的分析应用,离子方程式书写方法,掌握基础是关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
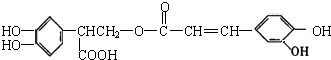
| A. | 迷迭香酸能使酸性高锰酸钾及溴的四氯化碳溶液褪色,属于芳香烃 | |
| B. | 迷迭香酸的分子式为C18H15O8,其在碱性条件下的水解反应叫皂化反应 | |
| C. | 迷迭香酸分子中含有5种官能团 | |
| D. | 1mol迷迭香酸跟H2反应,最多可消耗7molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
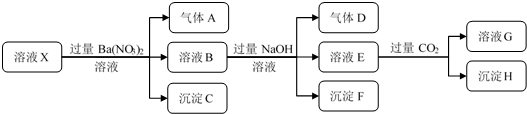
| A. | 溶液中一定没有Ba2+、NO3-、CO32- | |
| B. | 溶液中一定含有H+、NH4+、Fe2+、SO42-、Cl- | |
| C. | 沉淀H为一定Al(OH)3和BaCO3的混合物 | |
| D. | 若溶液X的体积为100 mL,产生标况下112 mL气体A,则X中c(Fe2+)=0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 16种 | C. | 32种 | D. | 64种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| C. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O是一种弱电解质 | B. | CO2是一种温室气体 | ||
| C. | HCOOH是一种一元弱酸 | D. | 该研究中能量转化方式只有1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
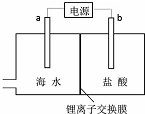 海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示?下列说法不正确的是( )
海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示?下列说法不正确的是( )| A. | a连接电源的正极 | |
| B. | Li+的移动方向是从海水进入到盐酸中 | |
| C. | 一段时间后,b电极附近溶液的pH降低 | |
| D. | 电解过程中还可能获得有经济价值的副产物氢气和氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g由S2、S4、S8组成的混合物中所含硫原子数为0.2NA | |
| B. | 用100ml 4mol/L盐酸与8.7g MnO2供热能制取氯气4.48L | |
| C. | 一定温度下,0.1L 0.1mol/L的CH3COOH溶液和1L 0.01mol/L 的CH3COOH溶液所含CH3COO-的数目均为0.01NA | |
| D. | 一定条件下,将1mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
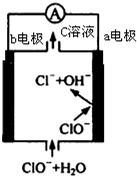 镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )
镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )| A. | 电池工作时,C溶液中的溶质是MgCl2 | |
| B. | 电池工作时,正极a附近的PH将不断增大 | |
| C. | 负极反应式:ClO --2e -+H2O═Cl-+2 OH- | |
| D. | b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com