
相同状况下,4体积NO2与1.5体积O2混合通过适量水,收集到的气体体积为( )
A.0.5体积 B.2体积
C.3体积 D.4.5体积
科目:高中化学 来源: 题型:
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶
液混合反应制备ClO2气体,再用水吸收该气体可得
ClO2溶液。在此过程中需要控制适宜的温度,若温
度不当,副反应增加,影响生成ClO2气体的纯度,
且会影响ClO2的吸收率,具体情况如图所示。
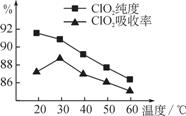
(1)据图可知,反应时需要控制的适宜温度是________℃,
要达到此要求需要采取的措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下可被ClO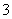 氧化成SO
氧化成SO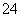 ,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式: 。
,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式: 。
(3)该小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品
6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.0500 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:
4H++ClO2+5Fe2+===Cl-+5Fe3++2H2O
14H++Cr2O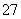 +6Fe2+===2Cr3++6Fe3++7H2O
+6Fe2+===2Cr3++6Fe3++7H2O
试计算ClO2的“产率” (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
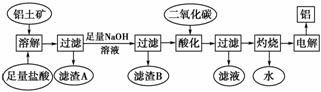
已知: 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;回答下列问题:
(1)向铝土矿中加入足量盐酸过滤后所得滤渣A的主要成分为________。
(2)在工艺流程中,加入足量氢氧化钠溶液过程中发生反应的离子方程式为__________________________________________________________________________,
过滤后所得滤渣B的成分为________。用二氧化碳酸化后过滤所得滤液中的溶质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
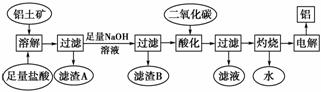
已知: 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;回答下列问题:
(1)向铝土矿中加入足量盐酸过滤后所得滤渣A的主要成分为________。
(2)在工艺流程中,加入足量氢氧化钠溶液过程中发生反应的离子方程式为__________________________________________________________________________,
过滤后所得滤渣B的成分为________。用二氧化碳酸化后过滤所得滤液中的溶质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中混有的少量杂质(括号中的物质)采用的操作方法,错误的是( )
A.N2(NO2)通过水洗气
B.NO(NH3)通过浓硫酸洗气
C.KCl(NH4Cl)用加热法分离
D.NH4Cl溶液(I2)用CCl4萃取分液
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )

A.挤压装置①的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。

请回答下列问题:
(1)A中加入的物质是________,发生反应的化学方程式是________________________________________________________________________。
(2)B中加入的物质是________,其作用是________________________________________________________________________________________________________________________________________________。
(3)实验时在C中观察到的现象是________________________________________________________________________,
发生反应的化学方程式是________________________________________________________________________。
(4)实验时在D中观察到的现象是________________________________________________________________________,
D中收集到的物质是_______,检验该物质的方法和现象是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
|
| A. | 由同种元素组成的物质肯定属于纯净物 |
|
| B. | 一种元素可形成多种离子,但只能是带同种电荷的离子 |
|
| C. | 含金属元素的离子不一定都是阳离子 |
|
| D. | 具有相同质子数的粒子都属于同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
___________________________________________________________。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)________________。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
A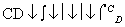 B(在水溶液中进行)
B(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式:_____________________________________________ ________________________;
D的电子式:________________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为____________________________;由A转化为B的离子方程式为________________________________________________________________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:______________________。A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由大到小的顺序是____________________________________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com