
����Ŀ��ij����С������ͼ1װ�ý���ʵ�飬�Իش��������⣮ 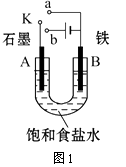
��1������ʼʱ����K��a���ӣ���B���ĵ缫��ӦʽΪ ��
��2������ʼʱ����K��b���ӣ���B���ĵ缫��ӦʽΪ �� �ܷ�Ӧ�����ӷ���ʽΪ �� �й�����ʵ�飬����˵����ȷ���ǣ�����ţ� ��
����Һ��Na+��A���ƶ�
�ڴ�A�����ݳ���������ʹʪ���KI������ֽ����
�۷�Ӧһ��ʱ������������ɻָ������ǰ����ʵ�Ũ��
������״����B������2.24L���壬����Һ��ת��0.2mol����
��3����С��ͬѧ��Ϊ�����ģ�ҵ�����ӽ���Ĥ�����ռ�ķ�������ô������������ͼ2װ�õ���������Һ����ȡ������������������������أ� 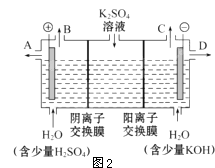
�ٸõ��۵�������ӦʽΪ ��
��ʱͨ�������ӽ���Ĥ��������������ڡ�����С�ڡ����ڡ���ͨ�������ӽ���Ĥ����������
�������Ƶõ�����������������������Һ���Ϊ����ȼ�ϵ�أ����������ĵ缫��ӦʽΪ
���𰸡�
��1��Fe��2e��=Fe2+
��2��2H++2e��=H2����2Cl��+2H2O ![]() 2OH��+Cl2��+H2�����ڢ�
2OH��+Cl2��+H2�����ڢ�
��3��4OH����4e��=2H2O+O2����С�ڣ�O2+2H2O+4e��=4OH��
���������⣺��1����ʼʱ����K��a�����γ�ԭ��ط�Ӧ��B�缫��������ʧ���������������ӣ��缫��ӦΪ��Fe��2e��=Fe2+ �� ���Դ��ǣ�Fe��2e��=Fe2+��
��2.������K��b���ӣ�װ��Ϊ���أ���Ϊ������������ԭ��Ӧ�������ӵõ�����������������B�缫��ӦΪ2H++2e��=H2������ⱥ��ʳ��ˮ�����������ơ�����������������ܷ�Ӧ�����ӷ���ʽΪ2Cl��+2H2O ![]() 2OH��+H2��+Cl2����
2OH��+H2��+Cl2����
�ٵ��������������������ƶ���BΪ�������ʢٴ���
��A������������ʹʪ��KI������ֽ�������ʢ���ȷ��
�۷�Ӧһ��ʱ��������HCl���壬�ɻָ������ǰ����ʵ�Ũ�ȣ����Ǽ������ᣬ�ʢ۴���
������״����B������2.24L������Ϊ�������ʵ���Ϊ0.1mol�����ݵ缫��Ӧ���㣬��2H++2e��=H2���õ���Һ��ת��0.2mol���ӣ��ʢ���ȷ��
���Դ��ǣ�2H++2e���TH2����2Cl��+2H2O ![]() 2OH��+H2��+Cl2�����ڢܣ�
2OH��+H2��+Cl2�����ڢܣ�
��3.���ٵ��ʱ��������ʧ���ӷ���������Ӧ����Һ�е����������ӵķŵ�����������������ӵķŵ���������������������������ʧ��������ˮ������4OH����4e��=2H2O+O2�����������������ӷŵ磬�������������������ƶ������������ӷŵ磬����������������ƶ�������ͨ����ͬ����ʱ��ͨ�������ӽ���Ĥ��������С��ͨ�������ӽ���Ĥ����������
���Դ��ǣ�4OH����4e��=2H2O+O2����С�ڣ�
��ȼ��ԭ����У�ȼ���ڸ�����ʧ���ӷ���������Ӧ���������������ϵõ��ӷ�����ԭ��Ӧ����ȼ��ԭ����У������������������������������ϵõ��Ӻ�ˮ��Ӧ�������������ӣ��缫��ӦʽΪO2+2H2O+4e��=4OH�� ��
���Դ��ǣ�O2+2H2O+4e��=4OH�� ��


 ���������ν�ϵ�д�
���������ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MgCl2��KCl��K2SO43������ɻ��Һ������Һ��n(K��)��1.5 mol��n(Mg2��)��0.5 mol��n(Cl��)��1.5 mol������Һ��n(SO42��)ӦΪ
A. 0.5 molB. 0.25 mol
C. 0.15 molD. 1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ����Cl2+2KBr====2KCl+Br2����KClO3+6HCl(Ũ)====3Cl2��+KCl+3H2O����2KBrO3+Cl2====Br2+2KClO3������˵����ȷ���� ( )
A. ����3����Ӧ�����û���Ӧ
B. ��������ǿ������˳��ΪKBrO3>KClO3>Cl2>Br2
C. ��Ӧ�������õ�6��72 L Cl2(��״��)�������ת�Ƹ���Ϊ3��01��1023
D. ����1 mol�������μӷ�Ӧ�õ����ӵ����ʵ���Ϊ2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Т١��ڡ��ۡ��ܱ�ʾ��ͬ��ѧԪ������ɵĻ������ͼ��ʾ���ĸ����幹�ɵĻ��������˵���������

A. ����ͼ�еĢ������õĴ������ʣ������֬��
B. ����ͼ�Т������ա����ݺ�ת�����ܣ���ܿ�����ˮ�Ҵ���ȡ
C. ��������ͼ�еĵ��壬���ұ�ʾ�Ļ�����Ϊ�ࣨ���ģ���
D. ���������������ᣬ���ɢ���ɵ��ҳ���ˮ���IJ�����5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.������һ�����ᣬ���ܺ�̼��Ʒ�Ӧ�ų�������̼����
B.������������
C.û�г����ƻ��֭�������ɫ�������ƻ��֭�ܻ�ԭ����������ͭ����Һ
D.���ࡢ��֬�������ʶ�����C��H��O����Ԫ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һϵ�з�Ӧ�����ղ���Ϊ�Ҷ��ᡣ
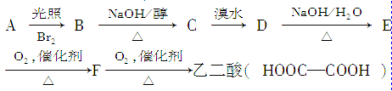
�Իش��������⣺
(1)C�Ľṹ��ʽ��______________��
B��C�ķ�Ӧ������________________��
E��F�Ļ�ѧ����ʽ��___________________��
(2)E���Ҷ��ᷢ��������Ӧ���ɻ�״������Ļ�ѧ����ʽ��__________________��
(3)��B����ˮ�ⷴӦ��C��H2O�����ӳɷ�Ӧ�����ɻ�����G�����Ҷ��ᡢˮ�����ӡ�G���ַ����У��ǻ�����ԭ�ӵĻ�������ǿ������˳����____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mL 18 mol��L��1��H2SO4��Һ�м���������ͭƬ�����ȡ���ַ�Ӧ����ԭ��H2SO4�����ʵ����� ��
A. ��0.45 mol B. ����0.45 mol
C. ��0.45��0.90 mol֮�� D. ����0.45 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ɫ����ˮ��Һ���ܴ����������������
A.Ba2+��SO42����K+B.NH4+��Na+��OH��
C.Cu2+��C1����NO3��D.Na+��C1����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����� 2 �� CH4 ���� x �����ӣ���ô 22 �� CO2 �������������ǣ� ��
A. x B. 4x C. 0.5x D. 3x
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com