
【题目】A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。

(1)若A、B、C三种物质的焰色反应均为黄色,A俗称苛性钠,W为无色无味气体,C受热分解可转化为B。
①向B溶液中通入W生成C的离子方程式为__________________________________。
②A溶液与C溶液反应的化学方程式为______________________________________。
(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠。
①A、B、C三种物质中所含有的金属元素单质与W反应的化学方程式为_____________。
②A溶液一步转化为C溶液的反应离子方程式为________________________________。
(3)若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g·mol-1。
①B的化学式为________________。
②实验室制取B时,_____________(填“能”或“不能”)用向上排空气法收集B。
③一定条件下B与CO反应的化学方程式为_____________________________。
(4)若A为淡黄色固体单质,W为气体单质,B、C均为酸性氧化物。则C溶于水形成化合物D,在加热的情况下,D的浓溶液与A反应的化学方程式为________________________。
【答案】CO32-+H2O+CO2=2HCO3- NaOH+NaHCO3=Na2CO3+H2O 2Al+2NaOH+2H2O =2NaAlO2 +3H2↑ Al3-+ 4OH- =AlO2- + 2H2O NO 不能 2NO+2CO![]() 2CO2+N2 S+2H2SO4(浓)
2CO2+N2 S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
【解析】
(1) 若A、B、C三种物质的焰色反应均为黄色,均含Na元素,A俗称苛性钠,则A为NaOH,W为无色无味气体,C受热分解可转化为B,则W为CO2、B为Na2CO3,C为NaHCO3;
(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠,则B为Al(OH)3,A为AlCl3、C为NaAlO2;
(3) 若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46gmol-1,则A为N2、W为O2、B为NO、C为NO2;
(4) 若A为淡黄色固体单质,W为气体单质,B、C均为酸性氧化物,则A为S,W为O2、B为SO2、C为SO3 。
(1) 若A、B、C三种物质的焰色反应均为黄色,均含Na元素,A俗称苛性钠,则A为NaOH,W为无色无味气体,C受热分解可转化为B,则W为CO2、B为Na2CO3,C为NaHCO3。
①向Na2CO3溶液中通入CO2生成NaHCO3的离子方程式为:CO32-+H2O+CO2=2HCO3-;
②NaOH溶液与NaHCO3溶液反应的化学方程式为:NaOH+NaHCO3=Na2CO3+H2O;
(2) 若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠,则B为Al(OH)3,A为AlCl3、C为NaAlO2;
①A、B、C三种物质中所含有的金属元素为Al,单质Al与NaOH溶液反应生成NaAlO2和氢气的化学方程式为2Al+2NaOH+2H2O =2NaAlO2 +3H2↑;
②AlCl3溶液中滴加过量NaOH溶液生成NaAlO2,发生反应的离子方程式为Al3-+ 4OH- =AlO2- + 2H2O。
(3) 若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46gmol-1,则A为N2、W为O2、B为NO、C为NO2;
①B的化学式为:NO;
②由于NO能与氧气反应,实验室制取NO时,不能用向上排空气法收集;
③NO与CO在催化剂作用下生成N2和CO2,发生反应的化学方程式为2NO+2CO![]() 2CO2+N2;
2CO2+N2;
(4) 若A为淡黄色固体单质,W为气体单质,B、C均为酸性氧化物,则A为S,W为O2、B为SO2、C为SO3 ;SO3溶于水形成化合物D为H2SO4,在加热的条件下,浓硫酸与硫反应的化学方程式为S+2H2SO4(浓) ![]() 3SO2↑+2H2O。
3SO2↑+2H2O。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】已知乙醇的分子结构如图:其中 ①②③④⑤表示化学键代号,用代号回答:
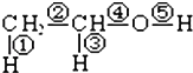
(1)乙醇与钠反应断裂的键是_______;
(2)乙醇与浓硫酸共热到170℃制乙烯,断裂的键是_______;
(3)乙醇与氧气在铜或银作催化剂,加热条件下反应断裂的键是_________;
(4)乙醇与乙酸在浓硫酸作用下反应断___________键.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.将等质量的锌片和铜片用导线相连插入500 mL CuSO4溶液中构成如图所示的装置。
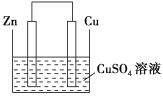
(1)该装置为____装置,该装置中发生反应的总离子方程式为____,铜片周围溶液会出现________的现象。
(2)若2 min后测得锌片的质量减少1.3 g,则导线中流过的电子为_____mol。
(3)若该装置的电解质溶液换为FeCl3溶液,其正极反应为_______。
Ⅱ.向2L密闭容器中通入amol气体A和b mol气体B,在一定条件下发生反应xA(g)+yB(g)![]() pC(g)+qD(g)。已知:平均反应速率v(C)=
pC(g)+qD(g)。已知:平均反应速率v(C)=![]() v(A);反应至2min时,A的物质的量减少了
v(A);反应至2min时,A的物质的量减少了![]() ,B的浓度减少了
,B的浓度减少了![]() amol/L,同时有amolD生成。
amol/L,同时有amolD生成。
(4)0~2 min内,v(A)=__________。
(5)该化学方程式中,y=__________。
(6)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较,反应速率____(填“增大”、“减小”或“不变”),理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.非金属元素的最高化合价不超过该元素的最外层电子数
B.非金属元素的最低负化合价的绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4![]() 2NO2 △H > 0)
2NO2 △H > 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )

A. (a)甲>乙,(b)甲>乙 B. (a)甲>乙,(b)甲=乙
C. (a)甲<乙,(b)甲>乙 D. (a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水化学资源开发利用的部分过程如图所示,下列说法正确的是

A. 从海水中得到粗盐主要是通过蒸发操作实现的
B. 用澄清的石灰水可鉴别NaHCO3和Na2CO3
C. 在步骤②中可通过直接加热的方法实现
D. 在步骤④中,SO2水溶液吸收Br2后,溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是

A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
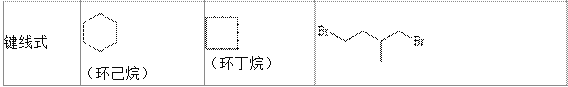
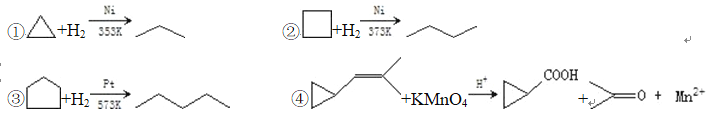
【题目】环丙烷可作为全身麻醉剂,环已烷是重要的有机溶剂,下面是部分环烷烃及烷烃衍生物的 结构简式、键线式和某些有机化合物的反应式(其中 Pt、Ni 是催化剂)。

回答下列问题:
(1)环烷烃与____________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是____________(填名称)。判断依 据为____________。
(3)环烷烃还可以与卤素单质,卤化氢发生类似的开环加成反应,如环丁烷与 HBr 在一定条件下反 应,其化学方程式为____________(不需注明反应条件)。
(4)写出鉴别环丙烷和丙烯的一种方法.试剂____________;现象与结论____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金(质量为m g)投入到50mL1mol/L的HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中正确的是

A. 假设a=25,整个反应过程中,主要发生了6个离子反应
B. c值越大,合金中Mg的含量越高
C. b值越大,合金中Al的含量越高
D. 根据图象判断,镁铝合金与50mL1mol/L的HCl溶液恰好完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com