
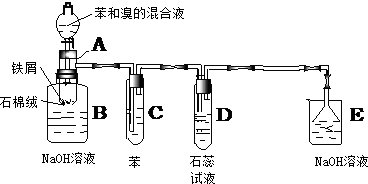

分析 (1)Fe与溴反应生成溴化铁,苯和液溴在溴化铁作催化剂条件下能发生取代反应生成溴苯与HBr;
(2)溴苯中的溴易挥发,非极性分子的溶质易溶于非极性分子的溶剂;该反应中有溴化氢生成,能与水蒸气结合成氢溴酸液滴,溴化氢溶于水得到氢溴酸,氢溴酸能使石蕊试液变红色;
(3)溴化铁与氢氧化钠反应生成氢氧化铁沉淀,氢氧化钠除去为反应的溴,溴苯与氢氧化钠溶液不互溶;
(4)HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸;
(5)本实验中进行尾气处理,防止污染空气.
解答 解:(1)Fe与溴反应生成溴化铁,苯和液溴在溴化铁作催化剂条件下能发生取代反应生成溴苯与HBr,反应方程式为:2Fe+3Br2=2FeBr3, ,
,
故答案为:2Fe+3Br2=2FeBr3; ;
;
(2)溴苯中的溴易挥发,溴和苯都是非极性分子,根据相似相溶原理知,溴易溶于苯,所以苯的作用是吸收溴蒸汽除去;该反应中有溴化氢生成,能与水蒸气结合成氢溴酸液滴,液面上有白雾,溴化氢溶于水得到氢溴酸,氢溴酸是酸性物质,能使石蕊试液变红色,
故答案为:吸收Br2蒸汽;,D管中石蕊试液变红,液面上有白雾;
(3)苯与液溴发生取代反应生成溴苯和溴化氢,溴苯是密度大于水,无色的油状液体,溴化氢易挥发,能与水蒸气结合成氢溴酸液滴,溴化铁与氢氧化钠反应生成红褐色的氢氧化铁沉淀,
故答案为:溶液中有红褐色的絮状物生成,底部有无色油状物质生成,液面上有白雾;
(4)HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸,装置D中导管口在液面上方,能防止倒吸,E中倒置漏斗增大了气体与氢氧化钠溶液的接触面积,有缓冲作用,能够防止倒吸,
故答案为:DE;
(5)本实验中进行尾气处理,环保,不会污染环境,
故答案为:环保,不会污染环境.
点评 本题为实验制备题目,涉及溴苯的制取,侧重考查学生对装置与原理的分析评价,难度不大.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:解答题
 某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.
某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.硫酸/mol•L-1 | 黑色物质出现的温度/°C | 黑色物质消失的温度/°C |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3CH3 | D. | CH3CH2CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| B. | 在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-7 mol/L | |
| C. | 浓度均为0.1 mol/L的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| D. | 向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石比石墨稳定 | |
| B. | 1 mol石墨所具有的能量比1 mol金刚石低 | |
| C. | 金刚石转变成石墨是物理变化 | |
| D. | 石墨和金刚石都是碳的同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1mol H2O 分解为H2与O2需吸收930 kJ热量 | |
| B. | H与O反应生成1mol H2O放出930 kJ热量 | |
| C. | 2 mol H的能量小于1mol H2的能量 | |
| D. | H结合成H2放出436 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com