
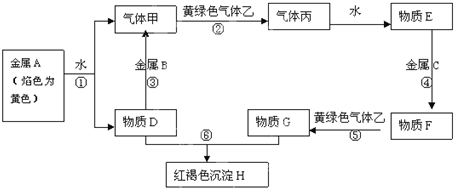
分析 金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl$\stackrel{金属C}{→}$物质F$\stackrel{Cl_{2}}{→}$物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,结合物质的性质解答该题结合物质的性质解答该题.
解答 解:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl$\stackrel{金属C}{→}$物质F$\stackrel{Cl_{2}}{→}$物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,
(1)由以上分析可知丙为HCl,G为FeCl3,
故答案为:HCl;FeCl3;
(2)反应①为Na和水的反应,离子方程式为2Na+2H2O═2Na++2OH-+H2↑,
反应⑤为氯气氧化氯化亚铁,离子方程式为2Fe2++Cl2═2Fe3++2Cl-,
故答案为:2Na+2H2O═2Na++2OH-+H2↑;2Fe2++Cl2═2Fe3++2Cl-;
(3)乙为Cl2,D为NaOH,乙+D的化学方程式为Cl2+2NaOH=NaCl+NaClO(次氯酸钠)+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查无机物的推断,题目难度中等,解答本题的关键是能根据物质的特性如颜色为突破口进行推断,答题时注意体会.


科目:高中化学 来源: 题型:多选题
| A. | H+、Na+、S2-、Cl- | B. | OH-、ClO-、SO42-、S2- | ||
| C. | H+、MnO4-、Cl-、K+ | D. | K+、NO3-、Cl-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B | B. | A=10-10 B | C. | B=10-4 A | D. | A=B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 | |
| B. | 若C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4 kJ•mol-1,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 | |
| D. | 若2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 元素Y与元素Z的最高正化合价之和的数值等于9 | |
| B. | 原子半径的大小顺序为:W>Z>Y | |
| C. | 离子半径的大小顺序为:W2->Y2->Z3+ | |
| D. | W的气态氢化物的热稳定性和还原性均比Q的氢化物的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al元素的第一电离能比Mg元素的大 | |
| B. | 第2周期元素的最高正化合价都等于其原子的最外层电子数 | |
| C. | 同一周期主族元素从左到右,原子半径和离子半径均逐渐减小 | |
| D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com