
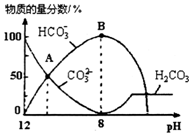
 25℃时,H2CO3的Kal=4.2×10-7,Ka2=5.6×10-11.室温下向10mL 0.1mo1•L-1Na2CO3溶液中逐滴加入0.1mo1•L-1HCl溶液.如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )
25℃时,H2CO3的Kal=4.2×10-7,Ka2=5.6×10-11.室温下向10mL 0.1mo1•L-1Na2CO3溶液中逐滴加入0.1mo1•L-1HCl溶液.如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )| A. | A点所示溶液的pH<11 | |
| B. | B点所示溶液:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | A点→B点发生反应的离子方程式为CO32-+H+═HCO3- | |
| D. | 分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成 |
分析 A.A点c(HCO3-)=c(CO32-),根据Ka2=$\frac{c(C{{O}_{3}}^{2-})×c({H}^{+})}{c(HC{{O}_{3}}^{-})}$计算;
B.根据物料守恒分析;
C.A点→B:CO32-逐渐减少,HCO3-逐渐增加;
D.用酚酞作指示剂,滴定产物是NaHCO3,用甲基橙作指示剂,滴定产物是H2CO3.
解答 解:A.A点c(HCO3-)=c(CO32-),Ka2=$\frac{c(C{{O}_{3}}^{2-})×c({H}^{+})}{c(HC{{O}_{3}}^{-})}$=5.6×10-11,则c(H+)=5.6×10-11mol/L,所以pH<11,故A正确;
B.室温下向10mL 0.1mo1•L-1Na2CO3溶液中逐滴加入0.1mo1•L-1HCl溶液,B点溶液中钠离子的物质的量浓度是含碳粒子的浓度的2倍,即c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),故B错误;
C.A点→B:CO32-逐渐减少,HCO3-逐渐增加,所以发生反应的离子方程式为CO32-+H+═HCO3-,故C正确;
D.1Na2CO3溶液中逐滴加入HCl,用酚酞作指示剂,滴定产物是NaHCO3,用甲基橙作指示剂滴定时NaHCO3与HCl反应产物是H2CO3,所以分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成,故D正确.
故选B.
点评 本题考查了弱电解质的电离、电离常数的计算,题目难度中等,明确弱电解质的电离特点、电离平衡常数与酸根离子水解程度的关系再结合守恒思想分析解答,试题培养了学生的灵活应用能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2molSO2 和 1molO2 混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 256g S8 分子中含 S-S 键为 7NA 个 | |
| C. | 由 1molCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为 NA 个 | |
| D. | 1 mol Na 与 O2 完全反应,生成 NaO2 和 Na2O2的混合物,转移电子总数为 NA 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a、b、d均可以与c形成两种或多种二元化合物 | |
| B. | 阴离子的还原性d大于c | |
| C. | a与d形成的化合物可以抑制水的电离 | |
| D. | 常温下,由这四种元素构成的某种盐的溶液pH=4,则水电离出的H+浓度肯定是1×10-4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
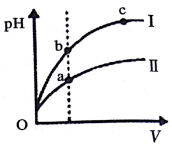
| A. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中不可能观察到有气泡产生 | |
| B. | 25℃时,将amol•L氨水与0.01mol•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(CI-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b | |
| D. | 向0.10mol•L-1NaHSO4溶液中通入NH3至溶液pH=7(通入气体对溶液体积的影响可忽略):c(Na+)>c(SO42-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C-O | O-H | C=O | O=O | C-C |
| 键能(kJ•mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com