
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | Fe Cl3溶液中加入足量的氨水:Fe3++3OH-=Fe (OH)3↓ | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+ | |
| D. | 用小苏打治疗胃酸过多病:HCO3-+H+=CO2↑+H2O |
分析 A.电荷不守恒;
B.一水合氨为弱碱,保留化学式;
C.不符合反应客观事实;
D.二者反应生成氯化钠和二氧化碳、水;
解答 解:A.钠与水反应,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.Fe Cl3溶液中加入足量的氨水,离子方程式:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,故B错误;
C.钠与CuSO4溶液反应,离子方程式:2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑,故C错误;
D.用小苏打治疗胃酸过多病,离子方程式:HCO3-+H+=CO2↑+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循电荷守恒规律,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | (1)(2) | B. | (2)(3) | C. | (3)(4) | D. | 都不符合 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新材料包括新型无机非金属材料和功能有机高分子材料 | |
| B. | 制作光导纤维的材料是单晶硅 | |
| C. | 美国国家实验室制备的类似于二氧化硅结构的二氧化碳原子晶体与干冰属于同分异构体 | |
| D. | 有机高分子材料全部是通过加聚反应或缩聚反应合成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常情况下,氨的溶解度不大 | B. | 溶于水的氨分子只有少量电量 | ||
| C. | 氨水中的NH3•H2O电离出少量OH- | D. | 氨本身的碱性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
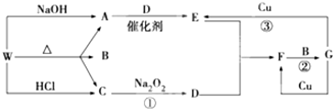
 ,F的颜色红棕色.
,F的颜色红棕色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,5-二甲基己烷的核磁氢谱中出现三组峰 | |
| B. | 丙烷分子的比例模型: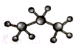 | |
| C. | 四氯化碳分子的电子式: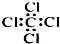 | |
| D. | 化合物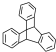 是苯的同系物 是苯的同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com