
| A.元素的原子半径呈周期性变化 |
| B.元素原子量的递增,量变引起质变 |
| C.元素的金属性和非金属性呈周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.类铅元素原子的最外层电子数为4 | B.其常见价态为+2、+3、+4 |
| C.它的金属性比铅弱 | D.它的原子半径比铅小? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
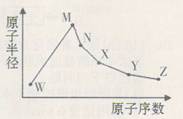
| A.W、X、Y三种元素最简单氢化物的稳定性:W>Y>X |
| B.M、X、Z三种元素形成的单质熔点:X>M>Z |
| C.Y、Z两种元素的含氧酸酸性:Z>Y |
| D.Y、Z两种元素的单核阴离子还原性:Y>Z |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 第一组 | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| 第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| 第三组 | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 第四组 | H2O 100.0 | H2S -60.2 | (d) -42.0 | H2Te -1.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
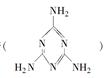 。下列关于三聚氰胺分子的说法正确的是
。下列关于三聚氰胺分子的说法正确的是| A.所有碳原子采用sp3杂化,所有氮原子采用sp3杂化 |
| B.一个分子中共含有15个σ键 |
| C.属于极性分子,故极易溶于水 |
| D.分子内既有极性键又有非极性键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.O2-1s22s22p4 | B.Ca [Ar]3d2 |
| C.Fe [Ar]3d54s3 | D.Si 1s22s22p63s23p2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
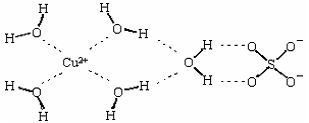
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
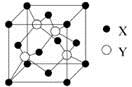
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com