
孔雀石的主要成分为Cu2(OH)2CO3。某校化学兴趣小组的同学设计从孔雀石中冶炼铜的方案如下:
回答下列问题:
(1)在粉碎后的孔雀石中加入稀硫酸,观察到的现象是_______________。
反应的离子方程式是___________________________________________。
(2)操作a中用到的玻璃仪器是____________________________________。
(3)A的化学式为________,在悬浊液中加入A的目的是______________。
(4)操作b包括洗涤和低温烘干,作用是__________________________。
(5)有同学认为,利用铁屑和稀硫酸,不通过上述实验方案,也能从孔雀石中冶炼铜。请你用简洁的文字说明不同方案的实验原理__________________。
科目:高中化学 来源: 题型:单选题
海水资源丰富,海水淡化问题已成为科学家的主要研究方向,若实行海水淡化来供应饮用水,下列方法不正确的是 ( )
| A.利用太阳能,将海水蒸馏淡化 |
| B.加入明矾,使海水的盐份沉淀并淡化 |
| C.通直流电,采用电渗透法使海水淡化 |
| D.通过离子交换膜,除去所含的盐分使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤是重要的能源,也是化工生产的重要原料。
(1)煤燃烧产生的废气直接排放到空气中,可能导致的环境污染问题是_______。
(2)下图是对煤矿燃烧产生的废气进行常温脱硫处理的流程示意图。
①废气脱硫过程中,主要反应的化学方程式为______________、_____________;
②在煤矿中直接添加一种物质,可有效减少煤矿燃烧产生的SO2,该物质是___;
③石膏的工业生产中的用途是_________________(写出一种用途即可)。
(3)煤经过___________(填加工方法)可以得到焦炉煤气、煤矿焦油和焦炭。煤焦油经过_______(填加工方法)可得到芳得族化合物。煤矿也可以用氢化法转化燃油,氢化法的本质是______________。
(4)煤可以液化转化为CH3OH,有人设计出在KOH溶液中用电极表面镀一层细小的铂粉做电极,铂吸附气体的能力强,性质稳定,利用CH3OH和O2构成的燃料电池的能量转化主要形式是 ,负极反应式为 ,电极表面镀铂粉的原因为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加顺序为________,原因是___________________________________。
(3)目前常用阴、阳离子交换树脂来进行水的软化,水中的Ca2+、Mg2+与交换树脂的____________起离子交换作用。当阴离子交换树脂失效后可放入__________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是将海水通过电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
①阳离子交换膜是指__________(填“A”或“B”)。
②写出通电后阳极区的电极反应式:_________________________________;
阴极区的现象是:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水占地球总储水量的97%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。也可以电解熔融氯化钠制得钠和氯气,该反应方程式为________________________。
(2)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下: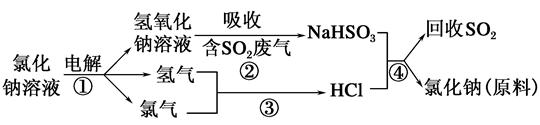
试写出反应的化学方程式:
②__________,③__________,④__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和 。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示: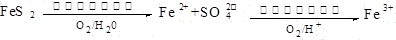
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ,第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨—空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上γ{n(O2)/n(NH3)}= ,实际生产要将γ值维护在1.7—2.2之间, 原因是 。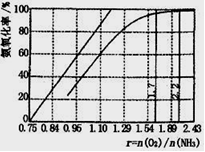
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下: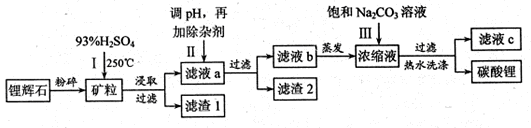
已知①2LiAlSi2O6+H2SO4 Li2SO4+Al2O3·4SiO2?H2O
Li2SO4+Al2O3·4SiO2?H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如下表
请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是 。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、 Mg2+ 、Ca2+ 、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时沉淀的杂质离子有 ;石灰石调节溶液PH的原理的离子方程式为 。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为 。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是 。
(5)从滤液c中可回收的主要物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NaCl是海水中含量最多的盐,除食用外,它还是海洋化学工业原料,下列以NaCl为原料的产品(或物质)是( )
①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸
| A.全部 | B.只有①②③④ |
| C.只有①②③⑤ | D.只有①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
下列推断不合理的是 ( )。
| A.生成1 mol(NH4)2SO4至少消耗2 mol NH3 |
| B.CO2可被循环使用 |
| C.往甲中通CO2有利于(NH4)2SO4的生成 |
| D.直接蒸干滤液即可得到纯净的(NH4)2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com