
 .
.
分析 (1)①镍原子核外电子数是28,根据镍离子的核外电子排布式可知镍元素化合价;
②分子晶体的熔沸点较低,价电子数相等、原子个数相等的微粒为等电子体;
(2)①根据晶胞结构图可知,以顶点上的铁原子为例,距离最近且相等的铁原子位于经过该顶点的12个面的面心上,据此答题;
②利用均摊法确定其化学式;
③(6)根据均摊法,可计算出1mol La的合金可吸附H2的数目.
解答 解:(1)①镍原子核外电子数是28,根据镍离子的核外电子排布式可知镍离子的核外有25个电子,所以镍元素化合价为+3价,
故答案为:+3;
②分子晶体的熔沸点较低,所以该物质为分子晶体,由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式为 ,
,
故答案为:分子晶体;
(2)①根据晶胞结构图可知,以顶点上的铁原子为例,距离最近且相等的铁原子位于经过该顶点的12个面的面心上,所以每个铁原子周围距离最近且相等的铁原子数目为12,
故答案为:12;
②该晶胞中镍原子个数=8×$\frac{1}{8}$,Te原子个数=2,则该晶胞中镍和碲原子个数之比为1:2,则其化学式为:NiTe2,
故答案为:NiTe2;
③根据均摊法,可知每个晶胞中含有La原子为8×$\frac{1}{8}$=1,而每个晶胞中含有氢分子的个数为:8×$\frac{1}{4}$+2×$\frac{1}{2}$=3,所以1mol La的合金可吸附H2的数目为3mol,
故答案为:3 mol或3NA.
点评 本题考查了物质结构和性质,涉及等电子体、晶体的计算、核外电子排布式的应用等知识点,这些知识点都是高考热点,学会根据均摊法确定物质的化学式,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 某课外活动小组模拟工业制备纯碱,方案如下:
某课外活动小组模拟工业制备纯碱,方案如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应②配平后,H2O的化学计量数为5 | |
| B. | Fe3O4既可看作是氧化物,又可看作是亚铁盐 | |
| C. | 反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂 | |
| D. | 碱性条件下,NaNO2的氧化性比Na2FeO2强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | X | Y | Z | W |  |
| A | Cu[ | CuSO4[来 | Cu(OH)2 | CuO | |
| B | Na | NaOH | NaCl | NaHCO3 | |
| C | 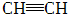 | CH2=CH2 | CH3CH3 | CH3CH2Cl | |
| D | Mg | MgO | MgSO4 | MgCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与足量盐酸混合:Ca(HCO3)2+2H+═Ca2++2CO2↑+2H2O | |
| B. | Na2CO3溶液中通入CO2气体:CO${\;}_{3}^{2-}$+CO2+H2O═2HCO${\;}_{3}^{-}$ | |
| C. | 实验室用NH4Cl固体与Ca(OH)2固体混合制NH3:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO${\;}_{3}^{2-}$+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO3稳定,H2SO3不稳定 | B. | HClO4比H2SO3酸性强 | ||
| C. | HCl溶液是强酸,H2S溶液是弱酸 | D. | Fe与Cl2生成FeCl3,Fe与S生成FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨反应中,断开1molN≡N键,同时生成6molN-H键,达化学平衡状态 | |
| B. | 有气体参与的可逆反应中,当反应容器中的压强保持不变时,达到化学平衡状态 | |
| C. | 当反应物或生成物在混合物中的百分含量保持不变时,即达到化学平衡状态 | |
| D. | 工业生产中采用高温是因为高温下反应物的转化率比低温时高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com