
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
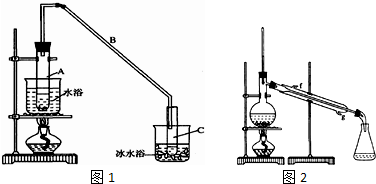
分析 (1)①通过水浴,可以使反应物受热均匀,便于控制温度;
②冰水浴的目的是降低环己烯蒸气的温度,使其液化;
(2)①环己烯不溶于氯化钠溶液,且密度比水小,分层后环己烯在上层,由于分液后环己烯粗品中还含有少量的酸和环己醇,提纯产物时用c(Na2CO3溶液)洗涤可除去酸;
②为了增加冷凝效果,冷却水从下口(g)进入;根据生石灰可以吸收水分析;
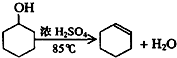
③根据表中数据可知,馏分环己烯的沸点为83℃;
a、若提前收集,产品中混有杂质,实际产量高于理论产量;
b、制取的环己烯物质的量增大,实验制得的环己烯精品质量高于理论产量;
c、粗产品中混有环己醇,导致测定消耗的环己醇量增大,制得的环己烯精品质量低于理论产量;
(3)根据混合物没有固定的沸点,而纯净物有固定的沸点,据此可判断产品的纯度.
解答 解:(1)①该反应温度为85℃,不易控制,而A采用水浴加热可使其均匀受热,且容易控制反应温度,
故答案为:均匀受热,容易控制反应温度;
②冰水浴的目的是降低环己烯蒸气的温度,使其液化,所以试管C置于冰水浴中目的为:进一步冷却,防止环己烯挥发,
故答案为:使进一步冷却,防止环己烯挥发;
(2)①环己烯是烃类,不溶于氯化钠溶液,且密度比水小,振荡、静置、分层后环己烯在上层,由于分液后环己烯粗品中还含有少量的酸和环己醇,联想:制备乙酸乙酯提纯产物时用c(Na2CO3溶液)洗涤可除去酸,
故答案为:上;c;
②为了增加冷凝效果,蒸馏装置要有冷凝管,冷却水从下口(g)进入;
蒸馏时要加入生石灰,生石灰能够吸收水分,便于蒸馏出更纯净的产品,
故答案为:g;生石灰吸收水分,便于蒸馏出更纯净的产品;
③根据表中数据可知,馏分环己烯的沸点为83℃,故收集产品应控制温度在83℃左右;
a、蒸馏时从70℃开始收集产品,提前收集,产品中混有杂质,实际产量高于理论产量,故a错误;
b、环己醇实际用量多了,制取的环己烯的物质的量增大,实验制得的环己烯精品质量高于理论产量,故b错误;
c、若粗产品中混有环己醇,导致测定消耗的环己醇量增大,制得的环己烯精品质量低于理论产量,故c正确;,故选c;
故答案为:83℃;c;
(3)区别粗品与精品可加入金属钠,观察是否有气体产生,若无气体,则是精品,另外根据混合物没有固定的沸点,而纯净物有固定的沸点,通过测定环己烯粗品和环己烯精品的沸点,也可判断产品的纯度,
故答案为:bc.
点评 本题通过以环己醇制备环己烯的实验,考查了制备方案的设计,涉及物质的分离方法,冷凝,产量的分析等知识,题目难度中等,明确实验目的、实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:推断题
 .
.
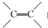 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.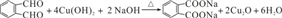 ;
;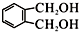 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.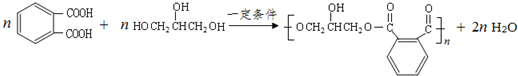 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
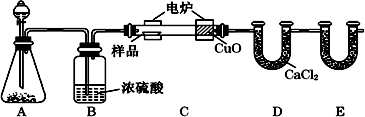
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
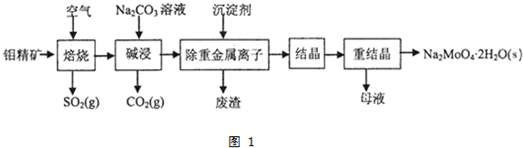
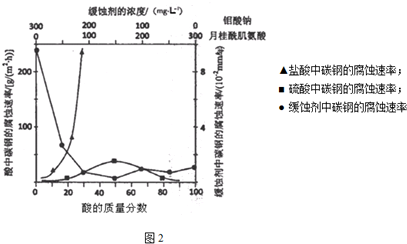
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

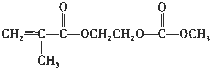 ,写出该单体与足量氢氧化钠溶液反应的化学方程式:
,写出该单体与足量氢氧化钠溶液反应的化学方程式: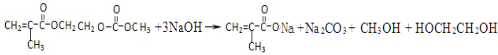 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
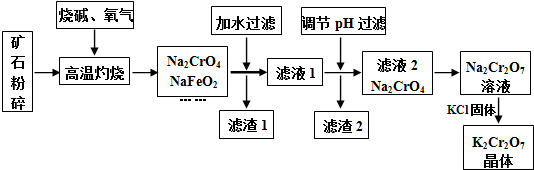
| 时间/(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| (CrO42-)/(mol•L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
| (Cr2O72-)/(mol•L-1) | 0 | 9.2×10-2 | 9.4×10-2 | 9.5×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L氯仿(CHCl3)含0.4NA个共价键 | |
| B. | 1molNaHSO4固体含3NA个离子 | |
| C. | NA个H2分子与NA个I2(g)分子反应生成HI(g),反应后容器中含2NA个分子 | |
| D. | 反应:K35ClO3+6H37Cl═3Cl2↑+KCl+3H2O,当有71gCl2生成时,转移0.5NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
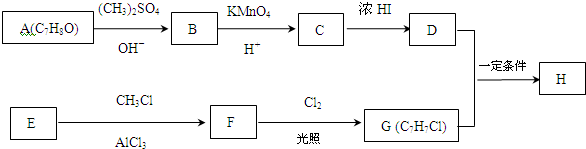
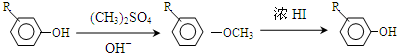

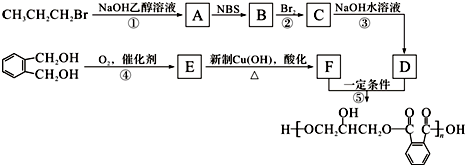
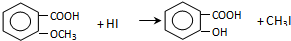 .
.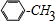 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$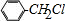 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.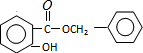 .
. (或
(或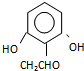 )(任写一种即可)
)(任写一种即可) 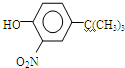
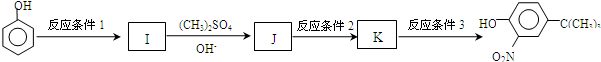
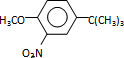 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com