
【题目】25℃时,将1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入CH3COOH 或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是

A. 该温度下,醋酸的电离平衡常数Ka=![]()
B. a点对应的混合溶液中c(CH3COOH)>c(Na+)>c(OH-)
C. 水的电离程度:c>b>a
D. 当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
【答案】A
【解析】1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合溶液的pH=4.3,溶液显酸性,加入醋酸后,溶液酸性增强,加入醋酸钠,溶液的酸性减弱。A.该温度下,1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合溶液的pH=4.3,醋酸的电离平衡常数Ka=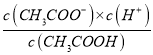 =
=![]() ≈
≈![]() =
=![]() ,故A错误;B. a点溶液的pH=3.1,是加入的醋酸后的结果,根据电荷守恒知,c(CH3COO-)>c(Na+),醋酸的电离程度较小,则c(CH3COOH)>c(Na+)>c(OH-),故B正确;C. a以醋酸的电离为主,抑制水的电离,酸性越强,水的电离程度越小,b点加入醋酸水的电离程度减小,c点加入醋酸钠,水的电离程度增大,故水的电离程度c>b>a,故C正确;D. 当混合溶液呈中性时,c(H+)=c(OH-),根据电荷守恒有c(Na+)=c(CH3COO-),则c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故D正确;故选A。
,故A错误;B. a点溶液的pH=3.1,是加入的醋酸后的结果,根据电荷守恒知,c(CH3COO-)>c(Na+),醋酸的电离程度较小,则c(CH3COOH)>c(Na+)>c(OH-),故B正确;C. a以醋酸的电离为主,抑制水的电离,酸性越强,水的电离程度越小,b点加入醋酸水的电离程度减小,c点加入醋酸钠,水的电离程度增大,故水的电离程度c>b>a,故C正确;D. 当混合溶液呈中性时,c(H+)=c(OH-),根据电荷守恒有c(Na+)=c(CH3COO-),则c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故D正确;故选A。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.研究物质的性质常用观察、实验、分类、比较等方法
B.多数金属氧化物属于碱性氧化物
C.能导电的物质不一定是电解质
D.盐酸能导电的原因是溶液在电流作用下电离生成了自由移动的离子的缘故
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质中是同系物的有________;互为同分异构体的有________;互为同素异形体的有________;互为同位素的有________;互为同一物质的有________; (1)液氯 (2)氯气 (3)白磷 (4)红磷 (5)氕 (6)氚 (7) ![]() (8)
(8) ![]() (9)CH2=CH﹣CH3 (10)
(9)CH2=CH﹣CH3 (10) ![]() (11)2,2﹣二甲基丁烷.
(11)2,2﹣二甲基丁烷.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
A.明矾溶液加热
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
【提出猜想】
猜想1:气体为CO2; 猜想2:气体为SO2; 猜想3:气体为CO2和SO2的混合气体。
为了验证猜想,该小组设计实验加以探究:
【实验探究】该小组同学按如图所示装置,将气体从a端通入,则:

(1)B中可以装下列________试剂(填编号)。
A、NaCl溶液 B、KMnO4溶液C、澄清石灰水
(2)A中品红溶液的作用是:_________________________________。
(3)C中品红溶液的作用是:_________________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色③D中澄清石灰水变浑浊
【得出结论】
(4)由上述现象该小组同学确认该气体的成分为:______________________。
(5)请写出SO2与氯水发生反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅资料发现,金属钠不仅能够跟氧气和水反应,还能跟很多种其他物质发生反应,其中包括与酒精在常温下反应,要研究金属钠和酒精反应的性质以及它与金属钠跟水反应的异同点,下列的研究方法中用不着的是( )
A.分类法B.观察法C.实验法D.比较法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)根据氧化还原反应2H2+O2═2H2O,设计成燃料电池,负极通的气体应是 , 正极通的气体应是 .
(2)根据选择电解质溶液的不同,填写下表:
电解质溶液 | H2SO4溶液 | KOH溶液 |
负极反应式 |
|
|
正极反应式 |
|
|
溶液的pH变化 |
|
|
(3)若把H2改为CH4 , KOH作电解质,则负极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com