
| A. | CH4 | B. | NH4+ | C. | Cl- | D. | NH2- |
分析 氢氧根离子中质子数为各元素的质子数之和,一个氢氧根离子中的质子数是9个,电子数是10个.
解答 解:氢氧根离子中质子数为各元素的质子数之和,一个氢氧根离子中的质子数是9个,电子数是10个.
A、甲烷分子中质子数是10,电子数是10,所以和氢氧根离子中质子数相同,电子数不同,故A错误;
B、铵根离子中质子数是11,电子数是10,所以和氢氧根离子中质子数不同,电子数相同,故B错误;
C、氯离子中质子数是17,电子数是18,所以和氢氧根离子中质子数和电子数都不同,故C错误.
D、NH2-中质子数是9,电子数是10,所以和氢氧根离子中质子数和电子数都相同,故D正确;
故选D.
点评 本题考查了离子中质子数和电子数的计算,难度不大,明确阳离子中质子数=电子数+电荷数,阴离子中质子数=电子数-电荷数.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | 操作 | 现象 |
 | 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
| A. | 烧杯A中发生反应:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | |
| B. | 红棕色气体消失只与NO2和烧杯C中的KI发生反应有关 | |
| C. | 烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关 | |
| D. | 若将铜片换成铁片,则C中的液体也可能变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
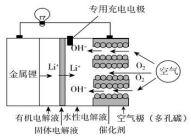 锂空气电池比锂离子电池具有更高的能量密度,前景非常广阔,其结构及工作原理如图(固体电解液只允许Li+通过),下列有关说法不正确的是( )
锂空气电池比锂离子电池具有更高的能量密度,前景非常广阔,其结构及工作原理如图(固体电解液只允许Li+通过),下列有关说法不正确的是( )| A. | 电池工作时,正极反应式:O2+2H2O+4e-=4OH- | |
| B. | 去掉固体电解液和有机电解质,电池反应发生改变 | |
| C. | 充电时,生成14 g Li,空气极质量增加16 g | |
| D. | 充电时,专用充电电极可以有效防止空气极腐蚀和劣化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应条件下,初始时向容器中充入2molSO2和1molO2,反应平衡时,可以释放198.0 kJ的热量 | |
| B. | 达到平衡时,SO2和SO3的浓度一定相等 | |
| C. | 反应体系中,当混合物的密度保持不变,反应达到平衡 | |
| D. | 增大压强和升高温度有利于加快反应速率,但升高温度对平衡转化率不利 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com