
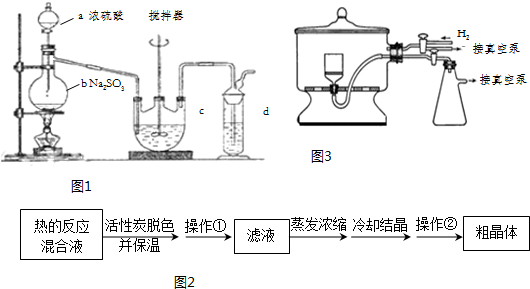
分析 (1)①由仪器结构可知,仪器b为蒸馏烧瓶;蒸馏烧瓶中浓硫酸与亚硫酸钠反应制备SO2,c装置中制备Na2S2O3,d装置吸收多余的二氧化硫,防止污染空气;
②b中制备SO2,浓硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫与水;
③控制反应温度或调节酸的滴加速度等控制SO2生成速率;
(2)需要趁热过滤,防止硫代硫酸钠晶体析出;
硫酸硫酸钠易溶于水,不溶于乙醇,为减少溶解单质的损失,应用乙醇洗涤;
硫代硫酸钠在空气中易被氧化;
(3)①KMnO4溶液具有强氧化性,可以腐蚀橡皮管;
②Na2S2O3反应完毕,再加入KMnO4标准溶液,颜色不褪去;
③由方程式可知n(Na2S2O3•5H2O)=n(S2O32-)=$\frac{5}{8}$n(KMnO4),进而计算Na2S2O3•5H2O在产品中的质量分数.
解答 解:(1)①由仪器结构可知,仪器b为蒸馏烧瓶;蒸馏烧瓶中浓硫酸与亚硫酸钠反应制备SO2,c装置中制备Na2S2O3,d装置吸收多余的二氧化硫,防止污染空气,应用氢氧化钠溶液吸收,
故答案为:蒸馏烧瓶;氢氧化钠溶液;
②b中制备SO2,浓硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Na2SO4+SO2↑+H2O;
③反应开始后,要控制SO2生成速率,可以采取的措施有:控制反应温度或调节酸的滴加速度等,
故答案为:控制反应温度或调节酸的滴加速度等;
控制SO2生成速率;
(2)需要趁热过滤,防止硫代硫酸钠晶体析出;
硫酸硫酸钠易溶于水,不溶于乙醇,为减少溶解单质的损失,应用乙醇洗涤;
用氢气排出空气,防止硫代硫酸钠被氧化,
故答案为:趁热过滤;乙醇;排出空气,防止硫代硫酸钠被氧化;
(3)①KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管中,
故答案为:酸式;
②Na2S2O3反应完毕,滴入最后一滴高锰酸钾标准液后,溶液恰好由无色变浅紫红色,且半分钟不褪色,说明反应到达终点,
故答案为:滴入最后一滴高锰酸钾标准液后,溶液恰好由无色变浅紫红色,且半分钟不褪色;
③由方程式可知n(Na2S2O3•5H2O)=n(S2O32-)=$\frac{5}{8}$n(KMnO4)=$\frac{5}{8}$×0.04L×0.2mol/L=0.005mol,则m(Na2S2O3•5H2O)=0.005mol×248g/mol=1.24g,则Na2S2O3•5H2O在产品中的质量分数为$\frac{1.24g}{1.5g}$×100%=82.7%,
故答案为:82.7%.
点评 本题考查物质制备实验、物质含量测定等,题目综合性较强,关键是对原理的理解,注意制备中渗入环保意识,熟练掌握元素化合物知识与实验制备基本原则,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料是造成雾霾天气的原因之一 | |
| B. | 从海水中提取氯化钠、溴、碘不一定都要通过化学反应才能实现 | |
| C. | 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生 | |
| D. | 用高纯度的硅来制备光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:| 实验序号 | 待测液体积(ML) | 所消耗NaOH标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入:_______. | _______,证明固体中含有碳酸氢铵. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com