
【题目】![]() 时,下列有关曲线与对应的叙述正确的是
时,下列有关曲线与对应的叙述正确的是
A.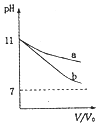 如图可表示体积均为
如图可表示体积均为![]() L、pH均为11的氨水与NaOH溶液分别用水稀释至VL情况,则b曲线为氨水
L、pH均为11的氨水与NaOH溶液分别用水稀释至VL情况,则b曲线为氨水
B.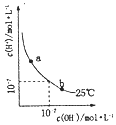 如图可表示水溶液中
如图可表示水溶液中![]() 与
与![]() 的浓度变化曲线,则升髙温度可实现
的浓度变化曲线,则升髙温度可实现![]()
C. 如图可表示体积均为100mL、pH均为3的盐酸与醋酸,分别与
如图可表示体积均为100mL、pH均为3的盐酸与醋酸,分别与![]() gZn反应,则a表示盐酸
gZn反应,则a表示盐酸
D. 如图可表示体积为
如图可表示体积为![]() 1
1![]() 盐酸用水稀释至VL情况,则
盐酸用水稀释至VL情况,则![]() 范围内:
范围内:![]()
【答案】D
【解析】
A. 一水合氨是弱电解质,氢氧化钠是强电解质,加水稀释溶液促进弱电解质电离,导致稀释溶液氢氧化钠溶液中氢氧根离子浓度变化较大,氨水中氢氧根离子浓度变化较小,pH变化较小,则a是氨水溶液,故A错误;
B. 升高温度促进水的电离,溶液中氢离子浓度和氢氧根离子的浓度均增大,![]() 的过程中氢氧根离子浓度增大,氢离子浓度减小,所以升高温度不能实现
的过程中氢氧根离子浓度增大,氢离子浓度减小,所以升高温度不能实现![]() ,故B错误;
,故B错误;
C. ![]() ,根据
,根据![]() 得,锌完全反应需要
得,锌完全反应需要![]() ,
,![]() 、100mL盐酸中
、100mL盐酸中![]() ,所以盐酸恰好反应,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,所以
,所以盐酸恰好反应,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,所以![]() 的100mL醋酸中醋酸的物质的量大于盐酸,则反应过程中醋酸溶液中氢离子浓度大于盐酸中氢离子浓度,所以醋酸与锌反应的速率快,即a表示醋酸,故C错误;
的100mL醋酸中醋酸的物质的量大于盐酸,则反应过程中醋酸溶液中氢离子浓度大于盐酸中氢离子浓度,所以醋酸与锌反应的速率快,即a表示醋酸,故C错误;
D. ![]() 盐酸的
盐酸的![]() ,溶液稀释
,溶液稀释![]() ,pH增大n个单位,所以体积为
,pH增大n个单位,所以体积为![]() 盐酸用水稀释至VL情况,则
盐酸用水稀释至VL情况,则![]() 范围内:
范围内:![]() ,故D正确。
,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】国际奥委会公布的违禁药物有138种,其中某种兴奋剂分子结构如图,关于它的说法正确的是( )

A. 该物质属于芳香烃
B. 该分子中所有碳原子共面
C. 1mol该物质与氢氧化钠溶液完全反应,最多消耗2molNaOH
D. 该物质的化学式为C15H24ClNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是
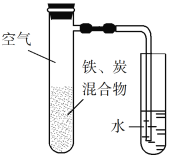
A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
![]()
已知转化过程中的反应为2CrO42-(aq)+2H+(aq) ![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有![]() 转化为Cr2O72-,下列说法不正确的是( )
转化为Cr2O72-,下列说法不正确的是( )
A.溶液颜色保持不变,说明上述可逆反应达到平衡状态
B.若用FeSO4作还原剂,处理1L废水,至少需要1.65mol
C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含锂废渣(主要金属元素的含量:Li~3.50%、Ni~6.55%、Ca~6.41%、Mg~13.24%)制备Li2CO3,并用其制备Li+电池的正极材料LiFePO4。部分工艺流程如下:
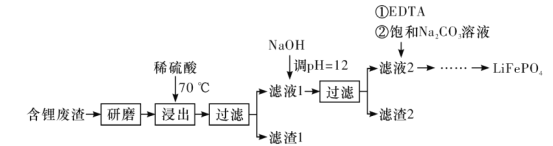
资料:i.滤液1、滤液2中部分离子的浓度(g·L-1):

ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物。
iii.某些物质的溶解度(S)如下表所示:
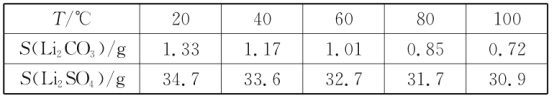
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是___。
(2)滤渣2的主要成分有___。
(3)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90°C下充分反应后,分离出固体Li2CO3粗品的操作是__。
(4)处理1kg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是__g。
II.纯化Li2CO3粗品
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是__,该池使用了__(填“阳”或“阴”)离子交换膜。

III.制备LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期,Y无最高正价,Z的含氧酸均具有氧化性,下列有关说法正确的是( )

A.WZ沸点高于W2Y的沸点
B.含Z的两种酸反应可制得Z的单质
C.W2Y2中既含离子键又含共价键键
D.X的含氧酸一定为二元弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如下:

已知:Ⅰ. NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ. Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2h,该操作的目的为____。
(2)“滤渣I”主要成分在工业上的用途为_______(只写1种即可),NH4Cl的电子式为_______。
(3)“一次碱析”时,加入的NaOH溶液需过量,含铬微粒发生反应的离子方程式为________。
(4)“氨解”的目的为_____________________。
(5)“氧化”时发生反应的离子方程式为___________________________。
(6)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于__________。(已知Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(7)“系列操作”具体是指____________、过滤、洗涤、干燥。若所得NiSO4·7H2O晶体不纯,应继续进行的提纯操作名称为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是( )
A. 常温下pH=7的溶液中:Fe3+、NO![]() 、Al3+、Cl-
、Al3+、Cl-
B. 水电离的c(H+)=1×10-13mol·L-1的溶液:Na+、NH4+、SO![]() 、CO
、CO![]()
C. 含有0.1mol·L-1Ca2+的溶液中:Na+、Cu2+、SiO![]() 、NO
、NO![]()
D. 含有大量NO![]() 的溶液:K+、Fe2+、SO
的溶液:K+、Fe2+、SO![]() 、Cl-
、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com