
| 离子 | H+ | K+ | NO3-[来源:.Com] | SO42- |
| 物质的量(mol) | 0.5 | 0.1 | 0.6 | 0.15 |
| m |
| M |
| 11g |
| 22g |
| 11g |
| 22g |
| 26.5g |
| 106g/mol |
| 0.9mol-0.6mol |
| 3 |
| 0.1mol |
| 0.2L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
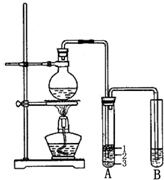 实验室制取少量溴乙烷的装置如图所示.
实验室制取少量溴乙烷的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
2- 8 |
2- 4 |
- 4 |
2- 8 |
2- 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 | 开始 | 8h | 16h | 24h | 32h | 40h | 48h |
| PH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 400℃~500℃ |
| 500℃~600℃ |
| 700℃~800℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com