
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程如图所示,下列说法不正确的是( )

A. 在沉淀池中应先通入氨气,再通入二氧化碳气体
B. 该反应原理: NH3+CO2+H2O=HCO3-+NH4+
C. 循环1中X是二氧化碳
D. 在过滤后的母液中加入氯化钠粉末、通入氨气,搅拌,经冷却结晶后可得氯化铵晶体
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 石油分馏、硝基苯的制备和乙烯的制取中温度计的位置都不相同
B. 向苯溴代实验后的溶液中加水,可观察到溶液分三层为有苯层、水层和溴苯层
C. 卤代烃中卤原子的检验,可以向卤代烃水解后的产物中直接滴加![]() 溶液
溶液
D. 乙醇与浓硫酸反应所制得的气体通入到溴水中,若溴水褪色即可证明有乙烯产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EPR橡胶(![]() )和PC塑料的合成路线如下:
)和PC塑料的合成路线如下:
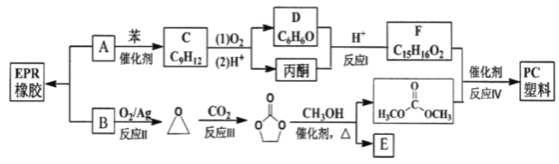
已知:
①![]() +
+![]() +
+![]()
②化合物F能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。
(1)下列说法正确的是______
A C不能使酸性高锰酸钾溶液褪色
B 反应Ⅱ、Ⅲ的原子利用率为100%
C 1molE与足量的金属钠反应,最多可生成22.4L的H2
D 塑料PC的合成中CH3OH可以循环使用
(2)反应Ⅳ的反应类型为______,F的结构简式为______
(3)反应Ⅳ的化学方程式是______
(4)写出同时满足下列条件的![]() 的所有同分异构体的结构简式(不考虑立体异构)______
的所有同分异构体的结构简式(不考虑立体异构)______
a 属于酯类 b 能发生银镜反应
(5)已知:![]() 以D与乙酸为其实原料合成
以D与乙酸为其实原料合成![]() ,无机试剂任选,写出合成路线(注:合成路线示意图:CH3CHO
,无机试剂任选,写出合成路线(注:合成路线示意图:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOHCH2CH3)______
CH3COOHCH2CH3)______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质能导电的是___,属于电解质的是___。
①NaCl晶体 ②液态SO2 ③液态醋酸 ④铜 ⑤BaSO4固体 ⑥纯蔗糖(C12H22O11) ⑦氨水 ⑧熔化的KNO3
(2)0.5molCH4的质量是___g,在标准状况下的体积为___L;
(3)8.4g氮气和9.6g某单质Rx所含原子个数相同,且分子个数之比为3:2,则x的值是___,R的摩尔质量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
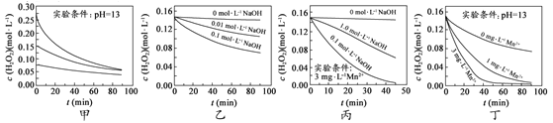
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。

(1)装置③的作用是______________________________。
(2)装置②中产生ClO2的化学方程式为________________________________。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③______________;④低于60 ℃干燥,得到成品。
(4)装置①、⑤的作用是______________________________。
(5)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象:取少量晶体溶于蒸馏水,___________________________________。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2+2S2O32-===2I-+S4O62-)。
(6)滴定中使用的指示剂是______________,达到滴定终点时的现象为__________。
(7)样品中NaClO2的质量分数为______________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

(1)通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为__________________ 、______________________,制得等量H2所需能量较少的是___________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率a1=_____ %,反应平衡常数K =___________。
②在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率a2 _____________a1,该反应的H __________0。(填“>” “<” 或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是 _____ (填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含amol NH4Fe(SO4)2和amol NH4HSO4溶液中逐滴加入bmol Ba(OH)2溶液,请计算
⑴当b=1,a=2时,溶液中产生沉淀的质量是___________g
⑵当b=2.5a时,溶液中产生沉淀的质量是__________________g(用a或b的表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的SO2与SO3质量之比为________,氧原子个数之比为________。
(2)在标准状况下,14g某气体的体积为11.2L,则该气体的相对分子质量是______________。
(3)在溶液中0.2 mol MnO4- 恰好能使0.5 mol SO32-离子完全氧化为SO42-,则Mn元素被还原后的化合价是________(填选项)。
A. +2 B. +3 C. +4 D. +5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com