
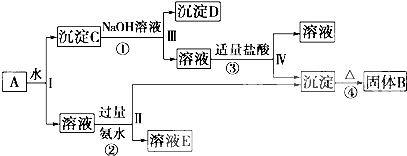
| ||
| ||


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
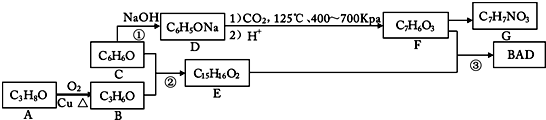
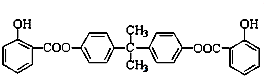
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、牙膏中甘油是保湿剂和甜味剂,可用新制氢氧化铜检验 |
| B、滴定实验中所用到的滴定管、移液管,在使用前均需干燥或用相应的溶液润洗,容量瓶、锥形瓶则不应润洗 |
| C、火柴头中的氯元素检验的实验中,将火柴头(未燃烧)浸于水中,片刻后取少量溶液,加AgNO3溶液、稀硝酸,若出现白色沉淀,证明有氯元素 |
| D、培养明矾晶体时,为得到较大颗粒的晶体,应自然冷却,并静置过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
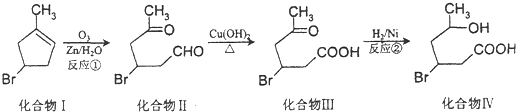
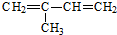 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和Ⅶ,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和Ⅶ,结构简式分别是为查看答案和解析>>
科目:高中化学 来源: 题型:
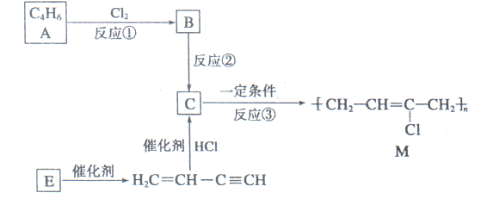
| 反应④ |
| 反应⑤ |
| 反应⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 对某固体进行焰色反应实验 | 火焰呈黄色 | 说明该物质仅为含钠化合物 |
| B | 在沸水中不断滴入饱和FeCl3溶液,持续加热 | 有红褐色沉淀生成 | 生成了Fe(OH)3胶体 |
| C | 向NaOH溶液中逐滴滴加AlCl3溶液 | 先生成白色沉淀后又逐渐溶解 | Al(OH)3能溶于NaOH溶液 |
| D | 向苯酚钠溶液中持续通入CO2气体 | 溶液变浑浊 | 酸性:碳酸>苯酚 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com