
短周期元素X、Y、Z在元素周期表中的位置如图所示.下列说法正确的是()

A. 原子半径的大小为:Z>Y>X
B. 气态氢化物的还原性:Z<Y
C. 若Y可作半导体材料,则X、Z的单质常温下均为气体
D. 若Y与Z的核电荷数之和为X的4倍,则X、Z各自形成的氢化物熔沸点:X<Z
考点: 位置结构性质的相互关系应用.
专题: 元素周期律与元素周期表专题.
分析: X、Y、Z三种短周期元素,则三种元素的原子序数不大于18,X与Z、Y的族序数分别相差1,则X处于第二周期,Y、Z处于第三周期,
A.同一周期,元素的原子半径随着原子序数的增大而减小,电子层数越多,原子半径越大;
B.同一周期,元素的非金属性随着原子序数的增大而增大,非金属性越强,则其氢化物越稳定,其还原性越弱;
C.若Y可作半导体材料,即Y为Si,则X为N、Z为S,S常温下为固体;
D.若Y与Z的核电荷数之和为X的4倍,设X为a,则Y为a+7、Z为a+9,即a+7+a+9=4a,解a=8,那么X为O,Y为P,Z为Cl,水中存在氢键,据此判断即可.
解答: 解:X、Y、Z三种短周期元素,则三种元素的原子序数不大于18,X与Z、Y的族序数分别相差1,则X处于第二周期,Y、Z处于第三周期,
A、同一周期,原子序数越小,半径越大,Y>Z,故A错误;
B.同一周期,元素的非金属性随着原子序数的增大而增大,非金属性越强,则其氢化物越稳定,其还原性越弱,Z的非金属性强于Y,故气态氢化物的还原性:Z<Y,故B正确;
C.若Y可作半导体材料,即Y为Si,则X为N、Z为S,S常温下为固体,故C错误;
D.若Y与Z的核电荷数之和为X的4倍,设X为a,则Y为a+7、Z为a+9,即a+7+a+9=4a,解a=8,那么X为O,Y为P,Z为Cl,O的氢化物为水,Z的氢化物为HCl,由于水中存在氢键,故水比氯化氢的熔沸点高,故D错误,
故选B.
点评: 本题主要考查元素位置结构性质的关系,明确元素周期律是解本题的关键,注意气态氢化物的稳定性与其还原性相反,为易错点.


科目:高中化学 来源: 题型:
向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)()
A. 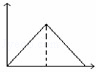 B.
B. 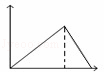 C.
C. 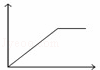 D.
D. 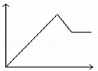
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对乙烯的叙述中错误的是()
A. 乙烯分子里所有原子都在同一平面上
B. 乙烯与Br2的加成,以及乙烯使酸性高锰酸钾溶液褪色,都与分子内含有碳碳双键有关
C. 乙烯分子中的碳碳双键是由两个碳碳单键构成
D. 乙烯分子中既含有极性键又含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
120℃,某气态烃在密闭容器中与足量的O2混合点燃,完全燃烧后恢复至原温度,容器内的压强保持不变,则该烃是()
A. CH4 B. C2H6 C. C3H6 D. C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列几组物质或微粒:
(1)属于同分异构体的是D;
(2)属于同位素的是A;
(3)属于同一种物质的是E;
(4)属于同系物的是B.
A.11H和12H B.甲烷和乙烷 C.金刚石、石墨和C60 D.丁烷和异丁烷
E. 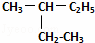 和
和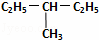 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是()
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是()
A. Na+、Fe2+、Cl﹣、ClO﹣ B. Na+、Cu2+、SO42﹣、NO3﹣
C. Mg2+、NH4+、SO42﹣、Cl﹣ D. Ba2+、HCO3﹣、NO3﹣、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
我国著名化学家张青莲教授主持测定的锌、锗等元素的相对原子质量数值,被国际原子量委员会采用为国际新标准.下表是元素周期表的一部分,下列说法正确的是( )
| 30 Zn 锌 65.38 | 32Ge 锗 72.63 |
|
| A. | 锌原子核内有32个质子 |
|
| B. | 锌元素的相对原子质量为65.38 |
|
| C. | 锗属于非金属元素 |
|
| D. | 锗原子中的中子数为32 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com