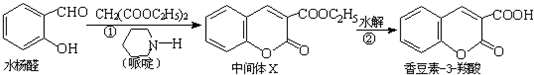
把a molO
2和b mol SO
2气体充入一密闭容器中,高温条件下发生反应O
2+2SO
2?2SO
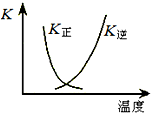
3(1)图中曲线表示上述反应的正、逆反应的平衡常数K随温度的变化,则上述反应正反应为
反应.(填“吸热”或“放热”)
(2)①若反应达平衡后SO
2、O
2和SO
3的物质的量之比为3:4:6,保持其它条件不变,降低温度后达到新的平衡时,O
2和SO
3的物质的量分别是1.1mol和2.0mol,此时容器内SO
2的物质的量应是
mol
②若要使平衡时反应物的总物质的量与生成物的总物质的量相等,则a、b之比k应满足
A.1<
<3 B.
<
<
C.3<
<4 D.
<
<
(3)在相同温度下,上述反应发生在体积相同的甲、乙两个容器中,a=b,达平衡过程中,甲保持体积不变,乙保持压强不变,若甲中SO
2的转化率为p%,则乙中SO
2的转化率
p% (填“<”,“>”或“=”)
(4)Li-SOCl
2电池常用于心脏起搏器,其电极材料分别为锂和碳,电解液是LiAlCl
4-SOCl
2.电池的总反应为:4Li+2SOCl
2=4LiCl+S+SO
2.电池正极发生的电极反应式为
.
(5)0.1mol/LKHSO
4和0.1mol/LNa
2S溶液等体积混合后,溶液能使pH试纸变蓝,则c(S
2-)+c(H
2S)+c(HS
-)+c(SO
42-)=
mol/L(假设H
2S气体不逸出)
(6)要使常温下0.2mol?L
-1CuSO
4溶液中Cu
2+沉淀较为完全(使Cu
2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH≥
(K
sp Cu(OH)
2=2×10
-20)



 把a molO2和b mol SO2气体充入一密闭容器中,高温条件下发生反应O2+2SO2?2SO3
把a molO2和b mol SO2气体充入一密闭容器中,高温条件下发生反应O2+2SO2?2SO3