
| A. | 三种金属物质的量相等 | B. | 三种金属均过量 | ||
| C. | 三种金属的质量相等 | D. | 盐酸均过量 |
分析 由电子守恒及原子守恒可知,存在Mg~MgCl2~H2↑、2Al~2AlCl3~3H2↑、Fe~FeCl2~H2↑,生成氢气的质量相等,即生成氢气的物质的量相等,结合反应计算.
解答 解:由电子守恒及原子守恒可知,存在Mg~MgCl2~H2↑、2Al~2AlCl3~3H2↑、Fe~FeCl2~H2↑,
A.设生成氢气均为3mol,则Mg、Al、Fe的物质的量分别为3mol、2mol、3mol,故A不选;
B.由于盐酸的体积、浓度相等,若金属都过量则盐酸完全反应,生成氢气的质量相等,故B选;
C.消耗镁、铝、铁三种金属的质量之比为3×24:2×27:3×56=12:9:28,则三种金属质量可能相同,也可能均过量时相同,故C不选;
D.盐酸可能均过量,也可能部分过量,故D不选;
故选B.
点评 本题考查金属与酸的反应,为高频考点,把握金属与酸反应中电子守恒及原子守恒得到关系式为解答的关键,侧重分析与计算能力的考查,题目难度不大,注意金属可能均过量也符合题意.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁是单质,又是导体 | |
| B. | 氧化物可分为金属氧化物和非金属氧化物 | |
| C. | 氯化钠是钠的化合物,又是氯化物 | |
| D. | 氢氧化钙是纯净物、化合物,又是碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 题中氯的化合价变化为:0→-1,被还原,NaOH是还原剂 | |
| B. | 题中氯的化合价变化为:0→+1,被氧化,NaOH是氧化剂 | |
| C. | NaOH既是氧化剂,又是还原剂 | |
| D. | Cl2→Cl-的变化不一定是加还原剂才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
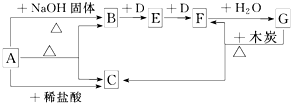
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(g)△H=-Q1kJ/mol; 2H2(g)+O2(g)=2H2O(g))△H=-Q2kJ/mol | |
| B. | S(g)+O2(g)=SO2(g)△H=-Q1kJ/mol; S(s)+O2(g)=SO2(g))△H=-Q2kJ/mol | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO2(g))△H=-Q1kJ/mol; C(s)+O2(g)=CO(g))△H=-Q2kJ/mol | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H=-Q1kJ/mol; $\frac{1}{2}$H2(g)+Cl2(g)=HCl(g))△H=-Q2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该原子质量为aNAg | ||
| C. | x g该氧原子所含的电子数为$\frac{8x}{a}$ | D. | y g 该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com