
甲醇可通过将煤气化过程中生成的CO和H2在一定条件下,发生如下反应制得:CO(g)+2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
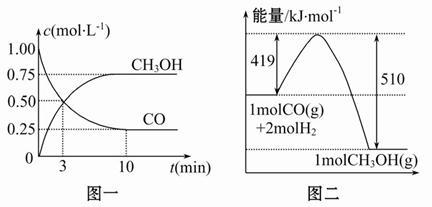
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=______,CO的转化率为________。
(2)该反应的平衡常数表达式为______________,温度升高,平衡常数______(填“增大”“减小”或“不变”)。
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则加入各物质后该反应向_____(填“正”“逆”)反应方向移动,理由是______________________
__________________________________________________________________。
(1)根据图一可知,反应开始到达到平衡的过程中CO的浓度变化为
0.75 mol·L-1,所以CO的反应速率为v(CO)=0.75 mol·L-1/10 min=
0.075 mol·L-1·min-1,根据反应速率之比等于化学计量数之比可知,v(H2)=2v(CO)=2×0.075 mol·L-1·min-1=0.15 mol·L-1·min-1,CO的转化率为0.75 mol·L-1/1.00 mol·L-1×100%=75%。
(2)该反应的平衡常数表达式为K=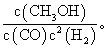 根据图二可知,反应物的能量比生成物的能量高,所以正反应为放热反应,升高温度,平衡常数减小。
根据图二可知,反应物的能量比生成物的能量高,所以正反应为放热反应,升高温度,平衡常数减小。
(3)因为反应物和生成物都是气体,反应过程中质量不变,气体的密度ρ=m/V。密度增大,说明容器的体积减小,因为反应在恒压的条件下进行,容器体积减小,说明反应后气体的物质的量减少,因为正反应方向是气体物质的量减少的反应,所以平衡向正反应方向移动。
答案:(1)0.15 mol·L-1·min-1 75%
(2)K=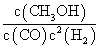 减小
减小
(3)正 反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积减小,平衡正移


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于离子键的特征的叙述中,正确的是
A.一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性
B.因为离子键无方向性,故阴、阳离子的排列是没有规律的、随意的
C.因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl-
D.因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空
(1)二氧化硫气体通入碘水,碘水褪色,该反应的化学方程式
(2)实验室制备氨气的化学方程式
(3)制备漂白粉的化学方程式
(4)收集满一烧瓶纯的二氧化氮气体做喷泉实验,假设溶液不扩散,所得溶液的物质的量浓度
(5)金属锌和硝酸物质的量之比为2:5恰好完全反应,该反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.Na2O2+2HCl====2NaCl+H2O2
B.Ag2O+H2O2====2Ag+O2↑+H2O
C.2H2O2====2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH====2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2仅体现氧化性的反应是(填序号,下同) ,H2O2既体现氧化性又体现还原性的反应是 。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是 。
(3)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、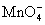 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①反应体系选择的酸是: (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸
②如果上述反应中有6.72 L(标准状况)气体生成,转移的电子为 mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+H2O2+H2O====A+NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在一个容积为1 L的密闭容器中,充入1 mol H2(g)和1 mol I2(g),发生反应H2(g)+I2(g) 2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,在该温度下,在另一个容积为2 L的密闭容器中充入1 mol HI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,在该温度下,在另一个容积为2 L的密闭容器中充入1 mol HI(g)发生反应HI(g)
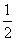 H2(g)+
H2(g)+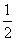 I2(g),则下列判断正确的是( )
I2(g),则下列判断正确的是( )
A.后一反应的平衡常数为1
B.后一反应的平衡常数为0.5
C.后一反应达到平衡时,H2的平衡浓度为0.25 mol·L-1
D.后一反应达到平衡时,HI(g)的平衡浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某固体物质只含有钠和氧两种元素,将它放在足量的水中产生两种气体,这两种气体又可以在一定条件下反应生成水,则原固体物质的组成是( )
A.Na2O2与Na2O B.Na和NaOH
C.Na2O2和Na D.Na和Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
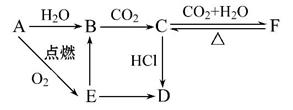
(1)写出A、B、C、D、E、F的化学式:
A. ;B. ;C. ;
D. ;E. ;F. 。
(2)写出有关反应的化学方程式(是离子反应的直接写出离子方程式)
B C: ___________________________________________________,
C: ___________________________________________________,
E B: __________________________________________________,
B: __________________________________________________,
C F: __________________________________________________,
F: __________________________________________________,
F C: __________________________________________________。
C: __________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.浓硫酸滴在润湿的蓝色石蕊试纸上,试纸先变红,然后褪色,最后变黑,说明浓硫酸具有酸性、氧化性和吸水性
B.样品 无明显现象
无明显现象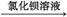 出现白色沉淀,说明样品中含S
出现白色沉淀,说明样品中含S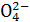
C.常温下浓硫酸能用铁制容器盛装,说明浓硫酸与Fe不反应
D.样品 得到使澄清石灰水变浑浊的气体,说明样品中含S
得到使澄清石灰水变浑浊的气体,说明样品中含S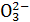 或HS
或HS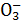
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,正确的是 ( )
A.原子半径:X>Y>Z>W B.金属性:X<Y,还原性:W 2- > Z-
C.原子最外层电子数:Y>X>Z>W D.原子序数:Y>X>Z>W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com