
【题目】查阅资料知:Br2的沸点为58.8 ℃,密度为3.119 g·cm-3,微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________态,保存时通常在盛溴的试剂瓶中加入少量________。
Ⅱ.工业生产中,海水提取溴常用热空气吹出法。其生产流程如下:

某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴。实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③关闭b,打开a,再通过A向B中通入足量的Cl2;
④将B中所得液体进行蒸馏,收集液溴。

(2)当观察到A中液面上方出现________(实验现象)时即可判断步骤①中反应已经结束。
(3)X试剂可以是________(填字母,下同),尾气处理选用________。
a.H2O b.饱和食盐水 c.氢氧化钠溶液 d.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为________________________________。
(4)蒸馏时应该选择______(填序号),操作中应控制的关键实验条件为____________。

Ⅲ.该实验小组利用制得的单质溴研究H2与Br2生成HBr的反应,实验装置如下:

(5)E装置可用来检验反应产物HBr,则D装置的作用是_______。若要检验E中收集的HBr,图示装置检验HBr还不够完善,请结合原有实验装置予以改进:__________。
【答案】(1)液;水(2)黄绿色
(3)d(2分) c(2分);Br2+SO32-+H2O=SO42-+2Br-+2H+(2分)
(4)①③⑤⑥⑦(2分) 控制温度在59℃(或58.8℃)
(5)除去未反应完的溴蒸气 在D与E之间增加一盛有CCl4的洗气装置(2分)
【解析】
试题Ⅰ.(1)溴在常温下为液态,液溴易挥发,密度大于水,微溶于水,所以保存时通常在盛溴的试剂瓶中加入少量水进行水封;
Ⅱ.(2)氯气与溴离子反应生成溴单质,当反应完成时,A中液面上方出现黄绿色;
(3)溴能够与亚硫酸钠反应生,可以用饱和亚硫酸钠溶液吸收溴;溴、氯气都有毒,可用碱液吸收;溴与亚硫酸钠溶液反应的离子方程式为Br2+SO32-+H2O=SO42-+2Br-+2H+;
(4)蒸馏操作的主要仪器是:带铁圈的铁架台,酒精灯,石棉网,蒸馏烧瓶,温度计,冷凝管,牛角管,锥形瓶,所以选择的仪器有:①③⑤⑥⑦;蒸馏实验依据的液体的沸点不同分离物质,所以实验中应控制的关键实验条件为温度,Br2的沸点为58.78℃,则应该控制温度在59℃;
Ⅲ.(5)生成的溴化氢中混有溴蒸气,由于溴的沸点较低,通过装置D可以除去溴化氢中的溴蒸气;由于装置D无法完全除去溴化氢中的溴单质,所以该方案不严密,应该在D与E之间增加一盛有CCl4的洗气装置,确保将溴化氢中的溴完全除去。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
B.氧化亚铁与稀盐酸混合:FeO+2H+=Fe3++H2O
C.氯化铝与过量氨水反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.氢氧化钡溶液与稀硫酸H2SO4反应:Ba2++SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30mL0.5mol/ L NaOH溶液加水稀释到 0.03 mol/L ,则选用的容量瓶规格为
A.100 mLB.250 mLC.500 mLD.1000 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的说法中,正确的是
A.合金的熔点一定比各成分金属的低
B.钢是目前用量最大、用途最广的合金
C.在我国使用最早的合金是生铁
D.储氢合金能大量吸收H2,但不与H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是
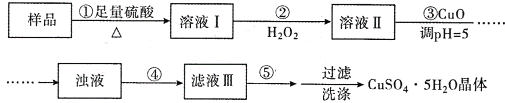
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤④为过滤,步骤⑤蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,一定不能自发进行的是( )
A. 2KClO3(s)===2KCl(s)+3O2(g) ΔH=-78.03kJ/mol ΔS=1110 J/(mol·K)
B. CO(g)===C(s,石墨)+![]() O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3kJ/mol ΔS=-280.1 J/(mol·K)
D. NH4HCO3(s)+CH3COOH(aq)===CO2(g)+CH3COONH4(aq)+H2O(l) ΔH=37.301kJ/mol ΔS=184.05 J/(mol·K)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法正确的是
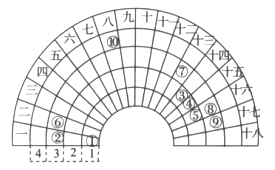
A. ②、⑧、⑨对应简单离子半径依次减小
B. 该表中标注的元素全部是主族元素
C. 元素⑥和⑦的原子序数相差11
D. ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应 2SO3(g)![]() 2SO2(g)+O2(g),若反应物浓度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反应的时间为
2SO2(g)+O2(g),若反应物浓度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反应的时间为
A. 等于10sB. 小于10sC. 等于20sD. 大于20s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应S(s)+O2(g)![]() SO2(g)△H<0,在其他条件不变时,改变其中一个条件,则生成SO2的速率:(填增大,减小或不变)
SO2(g)△H<0,在其他条件不变时,改变其中一个条件,则生成SO2的速率:(填增大,减小或不变)
(1)升温_____;
(2)增大压强_____;
(3)增大容器容积____;
(4)加入O2____;
(5)加入S_____;
(6)加正催化剂_____。
(7)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______。
A.消耗1molO2同时生成1molSO2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.v正(O2)=v逆(SO2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com