
【题目】某兴趣小组学生用如下图所示装置制取丙烯酸甲酯,步骤如下:
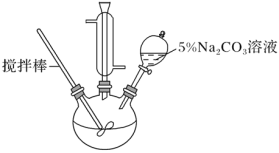
Ⅰ.取10.0 g丙烯酸(CH2=CHCOOH)和6.0 g甲醇、适量的浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
Ⅱ.充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗涤至中性。
Ⅲ.分液,取上层油状液体,加入无水Na2SO4固体,过滤后蒸馏,收集70~90 ℃馏分。
(1) 冷凝管的作用是______
(2) 该实验中可能生成有机副产物的结构简式为____(填一种即可)。
(3) 步骤Ⅱ中混合液用5% Na2CO3溶液洗涤的目的是_______。
(4) 步骤Ⅲ中加入无水Na2SO4固体的作用是______。
(5) 已知甲醇易挥发且有毒性,请写出1条在本实验中需要采取的安全防护措施_____。
【答案】冷凝回流,提高原料利用率 CH3OCH3 除去混合液中的丙烯酸、甲醇、硫酸 除去有机层中的水 在通风橱中实验、防止明火(或其他合理答案)
【解析】
(1)根据仪器的构造分析其作用;
(2)甲醇发生分子间脱水生成甲醚;
(3) 混合液中有丙烯酸甲酯、丙烯酸、甲醇,丙烯酸能与Na2CO3溶液反应,甲醇能溶于碳酸钠溶液中;
(4) 无水Na2SO4固体可作干燥剂;
(5) 已知甲醇易挥发且有毒性,应为在通风橱中实验、防止明火。
(1) 冷凝管的作用是冷凝回流,提高原料利用率;
(2) 该实验中甲醇可能发生分子间脱水生成甲醚,故生成有机副产物的结构简式为CH3OCH3;
(3) 混合液中有丙烯酸甲酯、丙烯酸、甲醇,丙烯酸能与Na2CO3溶液反应,甲醇能溶于碳酸钠溶液中,所以用5%Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度) ,故答案为: 除去混合液中的丙烯酸、甲醇、硫酸(降低丙烯酸甲酯的溶解度);
(4) 无水Na2SO4固体可作干燥剂,步骤Ⅲ中加入无水Na2SO4固体的作用是除去有机层中的水;
(5) 已知甲醇易挥发且有毒性,本实验中需要采取的安全防护措施为在通风橱中实验、防止明火。


科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ),
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ),
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=_____________mol,NO的转化率α1=______________。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2 ,其反应为:2CO+2NO![]() N2+2CO2 ΔH<0
N2+2CO2 ΔH<0
①在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是(________)
A.反应混合物各组分物质的量浓度相等
B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变
D.单位时间内消耗1molNO的同时,就有1molCO生成
②达到平衡后下列能提高NO转化率的是(________)
A.选用更有效的催化剂B.保持容器体积不变充入氦气增大压强
C.降低反应体系的温度D.缩小容器的体积
③研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | a | b | c | 124 |
Ⅲ | 350 | d | e | 124 |
表中:a=_______________,e=__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,R、Y位于同主族,X2 YR3水溶液在空气中久置,其溶液由碱性变为中性。下列说法正确的是( )
A.简单离了半径:X>Y>Z>R
B.X2Y与Z2反应可证明Z的非金属性比Y强
C.Y的氧化物对应的水化物一定是强酸
D.X和R组成的化合物只含一种化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成某药物的中间体,其合成路线如F(-Ph代表苯基):

(1)已知X是一种环状烃,则其化学名称是___。
(2)Z的分子式为___;N中含氧官能团的名称是__。
(3)反应①的反应类型是__。
(4)写出反应⑥的化学方程式:__。
(5)T是R的同分异构体,同时满足下列条件的T的同分异构体有___种(不包括立体异构)。写出核磁共振氢谱有五个峰的同分异构体的结构简式:___。
a.与氯化铁溶液发生显色反应
b.1molT最多消耗2mol钠
c.同一个碳原子上不连接2个官能团
(6)参照上述合成路线,结合所学知识,以![]() 为原料合成OHCCH2CH2COOH,设计合成路线:___(其他试剂任选)。
为原料合成OHCCH2CH2COOH,设计合成路线:___(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
则CO2催化氢化合成甲醇的热化学方程式:______________________。
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①该反应的化学平衡常数表达式为K=_____。
②由表中数据判断该反应的△H_____0(填“>”、“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为___________℃。
(4)要提高CO的转化率,可以采取的措施是(填字母序号)__________________.
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

①X表示的物理量是_____。
②判断L1与L2的大小关系:L1_____L2(填“<”,“=”或“>”),并简述理由:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是()
4NO(g)+6H2O(g),下列叙述正确的是()
A.达到化学平衡时,4v正(O2)=5v正(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g)下列叙述不正确的是
CH3CH2OH(g)+3H2O(g)下列叙述不正确的是
A.使用CuZnFe催化剂可大大提高生产效率
B.恒容时,充入大量CO2气体可提高H2的转化率
C.反应需在300 ℃时进行可推测该反应是吸热反应
D.从平衡混合气体中及时分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 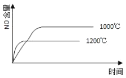
B. 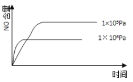
C. 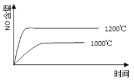
D. 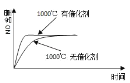
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000 mol/L NaOH溶液滴定20.00 mL 0.1000 mol/L的H3A溶液的滴定曲线如图所示。己知H3A的pKa1-pKa3分别为2、7和12(pKa=-lgKa)下列说法正确的是

A.滴定前溶液pH值约为3
B.第一个计量点可以用酚酞作为指示剂
C.到达第二个计量点时,溶液中存在c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-)
D.到达第三个计量点时,微热溶液,![]() 会增大
会增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com