
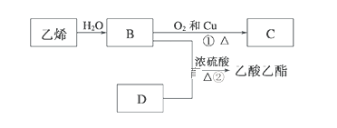
ЁОЬтФПЁПФГЛЏбЇбаОПадбЇЯАаЁзщЮЊСЫНтДгЙЄвЕфхжаЬсДПфхЕФЗНЗЈЃЌВщдФСЫгаЙизЪСЯЃЌBr2ЕФЗаЕуЮЊ59ЁцЃЌЮЂШмгкЫЎЃЌгаЖОадКЭЧПИЏЪДадЁЃЫћУЧВЮЙлЩњВњЙ§ГЬКѓЃЌЩшМЦСЫШчЯТзАжУМђЭМЃК
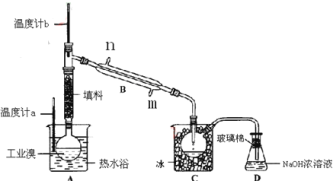
(1)зАжУBжБаЮРфФ§ЙмНјЫЎЗНЯђ______(ЬюЁАЂђЁБЛђЁАЂѓЁБ)ЃЌзАжУDЕФУћГЦЪЧ_________ЁЃ
(2)дкAдВЕзЩеЦПжаМгШывЛЖЈСПЙЄвЕфхКЭ2аЁЦЌЫщДЩЦЌЃЌМгШыЫщДЩЦЌЕФзїгУЪЧ_________ЃЛШчЙћМгШШвЛЖЮЪБМфКѓЗЂЯжЭќМЧМгЫщДЩЦЌЃЌгІИУВЩШЁЕФе§ШЗВйзїЪЧ_______(Ьюе§ШЗД№АИБъКХ)ЁЃAЃЎСЂМДВЙМг BЃЎРфШДКѓВЙМг CЃЎВЛашВЙМг DЃЎжиаТХфСЯ
(3)ећЬзЪЕбщзАжУжавЧЦїСЌНгОљВЛФмгУЯ№НКШћКЭЯ№НКЙмЃЌЦфдвђЪЧ_____________________ЁЃ
(4)ЪЕбщзАжУЦјУмадСМКУЃЌвЊДяЕНЬсДПфхЕФФПЕФЃЌВйзїжаШчКЮПижЦЙиМќЬѕМўЃК___________ЁЃ
(5)зАжУCЕФзїгУЃК_____________________ЁЃзАжУDЕФзїгУЪЧ________________________ЁЃ
(6)ЬсДПвКфхвВвЊгУЕНЗжвКВйзїЃЌЗжвКТЉЖЗдкЪЙгУЧАаыЧхЯДИЩОЛВЂ___________ЃЛгУCCl4ЬсШЁфхЪБЃЌВњЮягІИУДгЗжвКТЉЖЗЕФ______________(ЬюЁАЩЯПкЕЙГіЁБЛђЁАЯТПкЗХГіЁБ)ЁЃ
ЁОД№АИЁПЂѓ зЖаЮЦП ЗРжЙБЉЗа B Br2ИЏЪДЯ№НК ПижЦЮТЖШМЦbЕФЮТЖШЃЌВЂЪеМЏ59ЁцЕФСѓЗж РфФ§КЭЪеМЏвКфх 2NaOH+ Br2=NaBr+ NaBrO+H2O МьТЉ ЯТПкЗХГі
ЁОНтЮіЁП
ЃЈ1ЃЉИљОнЪЕбщЪвГЃМћвЧЦїМАЪЙгУЗНЗЈХаЖЯЃЛ
ЃЈ2ЃЉЫщДЩЦЌгУРДЗРжЙБЌЗаЃЌШчЙћЭќМЧМгЫщДЩЦЌЃЌгІРфШДКѓВЙМгЃЛ
ЃЈ3ЃЉИљОнфхОпгаЧПИЏЪДадЃЌПЩвдИЏЪДЯ№НКЗжЮіЃЛ
ЃЈ4ЃЉИљОнЗжСѓЪЧРћгУЛьКЯвКЬхЕФИїГЩЗжЗаЕуВЛЭЌЖјЗжРыХаЖЯЃЛ
ЃЈ5ЃЉзАжУCЪЧРфФ§фхЃЌЗРжЙфхЛгЗЂЃЛзАжУDЕФзїгУЪЧЮќЪеЛгЗЂЕФфхЃЛ
ЃЈ6ЃЉЗжвКТЉЖЗдкЪЙгУЧАвЊМьТЉЃЌфхЕФЫФТШЛЏЬМШмвКдкЯТВуЃЌДгЗжвКТЉЖЗЕФЯТПкЗХГіЁЃ
ЃЈ1ЃЉРфФ§ЙмЪЧЪЕбщЪвГЃМћЕФвЧЦїЃЌЪЙгУЪБРфФ§ЫЎДгЯТПкНјЃЌЩЯПкГіЃЌЫљвджБаЮРфФ§ЙмДгЂѓЗНЯђНјЫЎЃЛИљОнвЧЦїЕФНсЙЙПЩжЊзАжУDЕФУћГЦЪЧзЖаЮЦПЃЌЙЪД№АИЮЊЃКЂѓЃЌзЖаЮЦПЁЃ
ЃЈ2ЃЉЫщДЩЦЌвђЮЊБэУцгаКмЖраЁПзЃЌдкЪЕбщЪаНјааШмвКМгШШВйзїжагУРДЗРжЙБЌЗаЃЌЫщДЩЦЌгІИУдкШмвКМгШШЧАМгШыЃЌШчЙћЭќМЧМгШыЃЌЮЊСЫАВШЋЦ№МћЃЌвВгІИУНЋШмвКРфШДКѓдйааМгШыЃЌЙЪД№АИЮЊЃК
ЗРжЙБЉЗаЃЌBЁЃ
ЃЈ3ЃЉвђфхОпгаЧПИЏЪДадЃЌПЩвдИЏЪДЯ№НКЃЌЫљвдећЬзЪЕбщзАжУжавЧЦїСЌНгОљВЛФмгУЯ№НКШћКЭЯ№НКЙмЃЌЙЪД№АИЮЊЃКBr2ИЏЪДЯ№НКЁЃ
ЃЈ4ЃЉфхЕФЗаЕуЮЊ59ЁцЃЌИљОнЗаЕуВЛЭЌЖјЬсДПBr2ЃЌПЩВЩгУЫЎдЁМгШШЃЌВЂЭЈЙ§ЮТЖШМЦbПижЦКУЮТЖШЃЌВЂЪеМЏ59ЁцЪБЕФСѓЗжЃЌЙЪД№АИЮЊЃКПижЦЮТЖШМЦbЕФЮТЖШЃЌВЂЪеМЏ59ЁцЕФСѓЗжЁЃ
ЃЈ5ЃЉгУБљРфШДЕФФПЕФЪЧРфФ§фхЃЌЗРжЙфхЛгЗЂЃЛBr2гаЖОЃЌВЛФмХХЗХдкЛЗОГжаЃЌDЕФзїгУЪЧЮќЪеЛгЗЂЕФфхЃЌЗДгІЗНГЬЪНЮЊЃК2NaOH+Br2=NaBr+ NaBrO+H2OЃЌЙЪД№АИЮЊЃКРфФ§КЭЪеМЏвКфхЃЛ2NaOH+Br2=NaBr+ NaBrO+H2OЁЃ
ЃЈ6ЃЉЗжвКТЉЖЗдкЪЙгУЧАМьТЉЪЧБивЊВйзїВНжшЃЌгУCCl4ЬсШЁфхЪБЃЌвђЮЊCCl4ЕФУмЖШБШЫЎЕФУмЖШДѓЃЌЙЪфхЕФЫФТШЛЏЬМШмвКдкЯТВуЃЌДгЗжвКТЉЖЗЕФЯТПкЗХГіЃЌЙЪД№АИЮЊЃКМьТЉЃЌЯТПкЗХГіЁЃ


 ПЮЬУШЋНтзжДЪОфЖЮЦЊеТЯЕСаД№АИ
ПЮЬУШЋНтзжДЪОфЖЮЦЊеТЯЕСаД№АИ ВНВНИпПкЫуЬтПЈЯЕСаД№АИ
ВНВНИпПкЫуЬтПЈЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГаЃЛЏбЇаЫШЄаЁзщЕФЭЌбЇдЫгУЕЮЖЈЗЈЖдвЛКЌгаЩйСПNa2SO4ЕФNaOHбљЦЗжаNaOHЕФКЌСПНјааВтЖЈЃЌЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉгУЗжЮіЬьЦНзМШЗГЦШЁИУбљЦЗ5.360gЃЌШЋВПШмгкЫЎХфжЦГЩ1000.0mLЕФШмвКЁЃгУМюЪНЕЮЖЈЙмШЁЦфжа20.00mLЗХдкзЖаЮЦПжаЃЌЕЮМгМИЕЮМзЛљГШзіжИЪОМСЁЃгУБъзМЕФбЮЫсШмвКЕЮЖЈД§ВтЕФЧтбѕЛЏФЦШмвКЪБЃЌзѓЪжАбЮеЫсЪНЕЮЖЈЙмЕФЛюШћЃЌгвЪжвЁЖЏзЖаЮЦПЃЌблОІзЂЪгзХ____ЁЃЕЮЖЈжеЕуЕФЯжЯѓЪЧ____________ЁЃ
ЃЈ2ЃЉЯТСаВйзїжаПЩФмЪЙЫљВтЧтбѕЛЏФЦШмвКЕФХЈЖШЪ§жЕЦЋЕЭЕФЪЧ_____(ЬюаДађКХ)
AЃЎЫсЪНЕЮЖЈЙмЮДгУБъзМбЮЫсШмвКШѓЯДОЭжБНгзЂШыБъзМбЮЫсШмвК
BЃЎЕЮЖЈЧАЪЂЗХЧтбѕЛЏФЦШмвКЕФзЖаЮЦПгУеєСѓЫЎЯДОЛКѓУЛгаИЩдя
CЃЎЫсЪНЕЮЖЈЙмдкЕЮЖЈЧАгаЦјХнЃЌЕЮЖЈКѓЦјХнЯћЪЇ
DЃЎЖСШЁбЮЫсЬхЛ§ЪБЃЌЕЮЖЈНсЪјЪБИЉЪгЖСЪ§
ЃЈ3ЃЉШєЕЮЖЈПЊЪМКЭНсЪјЪБЃЌЫсЪНЕЮЖЈЙмжаЕФвКУцШчЭМЫљЪОЃКдђЕЮЖЈжеЕуЕФЖСЪ§ЮЊ____mLЁЃ

ЃЈ4ЃЉФГбЇЩњИљОнШ§ДЮЪЕбщЗжБ№МЧТМгаЙиЪ§ОнШчЯТЃК
ЕЮЖЈДЮЪ§ | Д§ВтЧтбѕЛЏФЦШмвКЕФЬхЛ§/mL | 0.1000mol/LбЮЫсЕФЬхЛ§ЃЈmLЃЉ | ||
ЕЮЖЈЧАПЬЖШ | ЕЮЖЈКѓПЬЖШ | |||
Ек1ДЮ | 20.00 | 0.00 | 26.01 | |
Ек2ДЮ | 20.00 | 1.56 | 30.30 | |
Ек3ДЮ | 20.00 | 0.22 | 26.21 | |
ЧыбЁгУЦфжаКЯРэЕФЪ§ОнСаЪНМЦЫуГіИУбљЦЗжаNaOHЕФжЪСПАйЗжКЌСПЁЃ(аДГіМЦЫуЙ§ГЬ)__
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГаЁзщгћРћгУCuOгыNH3ЗДгІЃЌбаОПNH3ЕФФГжжаджЪВЂВтЖЈЦфзщГЩЃЌЩшМЦСЫШчЯТЪЕбщзАжУ(МаГжзАжУЮДЛГі)НјааЪЕбщЃК
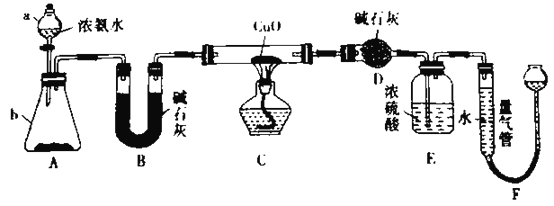
ЛиД№ЯТСаЮЪЬтЃК
(l)вЧЦїaЕФУћГЦЮЊ____________ЃЌвЧЦїbжаПЩбЁдёЕФЪдМСЮЊ___________ЁЃ
(2)ЪЕбщЪвжаЃЌРћгУзАжУAЃЌЛЙПЩжЦШЁЕФЮоЩЋЦјЬхЪЧ___________(ЬюБъКХ)ЁЃ
A.Cl2 B.O2 C.NO2 D.CO2
(3)ЪЕбщжаЙлВьЕНзАжУCжаКкЩЋCuOЗлФЉБфЮЊКьЩЋЙЬЬхЃЌСПЦјЙмгаЮоЩЋЮоЮЖЕФЦјЬхВњЩњЃЌЩЯЪіЯжЯѓжЄУїMH3Опга_______адЃЌзАжУCжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___ЁЃ
(4)зАжУEжаХЈСђЫсЕФзїгУЪЧ___________ЁЃ
(5)ЖСШЁЦјЬхЬхЛ§ЧАЃЌгІЖдзАжУFНјааЕФВйзїЪЧ________ЁЃ
(6)ЪЕбщЭъБЯЃЌШєВтЕУзАжУDдіжиm gЃЌзАжУFВтЖЈЦјЬхЕФЬхЛ§ЮЊn L(вбВ№ЫуГЩБъзМзДПі)ЃЌдђАБЗжзгжаЕЊЁЂЧтЕФдзгИіЪ§БШЮЊ_______________(гУКЌmЁЂnзжФИЕФДњЪ§ЪНБэЪО)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯЗњЦјПЩзїЮЊЛ№М§ШМСЯжаЕФбѕЛЏМСЃЌЗњЕЅжЪЕФжЦБИЭЈГЃВЩгУЕчНтЗЈЁЃвбжЊЃКKFЃЋHF===KHF2ЃЌЕчНтШлШкЕФЗњЧтЛЏМи(KHF2)КЭЮоЫЎЗњЛЏЧтЕФЛьКЯЮяжЦБИF2ЕФзАжУШчЭМЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ

A. ИжЕчМЋгыЕчдДЕФИКМЋЯрСЌ
B. ЕчНтЙ§ГЬжаашВЛЖЯВЙГфЕФXЪЧKF
C. вѕМЋЪвгыбєМЋЪвБиаыИєПЊ
D. ЗњЧтЛЏМидкЗњЛЏЧтжаПЩвдЕчРы
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдчЦкЗЂЯжЕФвЛжжЬьШЛЖўЪЎУцЬхзМОЇПХСЃгЩCuЁЂFeЁЂAlШ§жжН№ЪєдЊЫизщГЩЃЌЛиД№ЯТСаЮЪЬтЃК
(1)зМОЇЪЧвЛжжЮоЦНвЦжмЦкађЃЌЕЋгабЯИёзМжмЦкЮЛжУађЕФЖРЬиОЇЬхЃЌПЩЭЈЙ§_________ЗНЗЈЧјЗжОЇЬхЁЂзМОЇЬхКЭЗЧОЇЬхЁЃ
(2)ЛљЬЌCuдзгзюИпФмВуЗћКХ_________ЃЌCuЮЛгкжмЦкБэ________ЧјЃЛаТжЦБИЕФCu(OH)2ПЩНЋБћШЉ(CH3CH2CHO)бѕЛЏГЩБћЫсЃЌЖјздЩэЛЙдГЩCu2OЃЌCu2OжаCuдЊЫиЕФЛЏКЯМлЮЊ_________ЁЃ1molБћШЉЗжзгжаКЌгаЕФІвМќЕФЪ§ФПЮЊ_________ЃЌБћЫсЕФЗаЕуУїЯдИпгкБћШЉЃЌЦфжївЊдвђЪЧ_________________ЁЃ
(3)вбжЊЃК
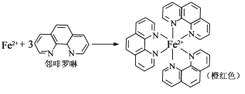
ЂйFe2+гыСкЗШТопјаЮГЩЕФХфКЯЮя(аЮГЩЙ§ГЬШчЭМ)жаЃЌХфЮЛЬхЮЊ_________________ЃЌХфЮЛдзгЪ§ЮЊ__ЁЃ
ЂкЬњФмгыЕЊаЮГЩвЛжжДХадВФСЯЃЌЦфОЇАћНсЙЙШчЭМЃЌдђИУДХадВФСЯЕФЛЏбЇЪНЮЊ___________ЁЃ
ЂлФђЫи(H2NCONH2)ПЩгУгкжЦгаЛњЬњЗЪЃЌжївЊДњБэга[Fe(H2NCONH2)6](NO3)3[Ш§ЯѕЫсСљФђЫиКЯЬњ(Ђѓ)]ЁЃФђЫиЗжзгжаCЁЂNдзгЕФдгЛЏЗНЪНЗжБ№ЪЧ________ЁЂ_________ЃЛгыNO3-ЛЅЮЊЕШЕчзгЬхЕФвЛжжЛЏКЯЮяЪЧ_________(аДЛЏбЇЪН)ЁЃ
(4)AlЕЅжЪЮЊУцаФСЂЗНОЇЬхЃЌЦфОЇАћВЮЪ§aЃН0.405nmЃЌОЇАћжаТСдзгЕФХфЮЛЪ§ЮЊ______ЃЌСаЪНБэЪОAlЕЅжЪЕФУмЖШ_________________gcmЉ3(ВЛБиМЦЫуГіНсЙћ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮвЙњПЦбЇМвПЊЗЂЩшМЦвЛжжЬьШЛЦјЭбСђзАжУЃЌРћгУШчгвЭМзАжУПЩЪЕЯжЃКH2S+O2ЁњH2O2 +SЁЃвбжЊМзГижагаШчЯТЕФзЊЛЏЃК


ЯТСаЫЕЗЈДэЮѓЕФЪЧЃК
A. ИУзАжУПЩНЋЙтФмзЊЛЏЮЊЕчФмКЭЛЏбЇФм
B. ИУзАжУЙЄзїЪБЃЌШмвКжаЕФH+ДгМзГиОЙ§ШЋЗњЛЧЫсФЄНјШыввГи
C. МзГиЬМАєЩЯЗЂЩњЕчМЋЗДгІЃКAQ+2H+ +2e- =H2AQ
D. ввГиЂйДІЗЂЩњЗДгІЃКH2S+I3- =3I-+SЁ§+2H+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПIЃЎвбжЊввЯЉФмЗЂЩњвдЯТзЊЛЏЃК
ЃЈ1ЃЉBЕФНсЙЙМђЪНЮЊЃК________ЃЛ
ЃЈ2ЃЉCжаЙйФмЭХЕФУћГЦЃК_______ЃЛ
ЃЈ3ЃЉЂйЕФЗДгІРраЭЃК_________ЃЛ
ЃЈ4ЃЉввЯЉгыфхЫЎЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК__________ЃЛ
ЃЈ5ЃЉаДГіЂкЕФЛЏбЇЗДгІЗНГЬЪНЃК______________ЁЃ
Ђђ.НёгаЯрЖдЗжзгжЪСПЮЊ58ЕФМИжжгаЛњЮяЃЌЪдаДГіЗћКЯЬѕМўЕФгаЛњЮяЕФНсЙЙМђЪН
ЃЈ1ЃЉШєИУгаЛњЮяЮЊЬўЃЌдђПЩФмЕФНсЙЙМђЪНЮЊЃК_______ЁЂ______ЁЃ
ЃЈ2ЃЉШєИУгаЛњЮяЪЧвЛжжБЅКЭвЛдЊШЉЃЌдђЦфНсЙЙМђЪНЮЊЃК_______ЁЃ
ЃЈ3ЃЉШєИУгаЛњЮя1molФмгызуСПвјАБШмвКзїгУПЩЮіГі4molAgЃЌдђгаЛњЮяЕФНсЙЙМђЪНЮЊЃК________ЁЃ
ЃЈ4ЃЉШєИУгаЛњЮяФмгыН№ЪєФЦЗДгІЃЌгжФмЪЙфхЕФЫФТШЛЏЬМШмвКЭЪЩЋЃЌдђИУгаЛњПЩФмЪЧЃК______ЁЃЃЈзЂєЧЛљСЌдкЫЋМќЩЯЕФгаЛњЮяМЋВЛЮШЖЈЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
A. CaCO3(s)===CaO(s)ЃЋCO2(g)ЪвЮТЯТВЛФмздЗЂНјааЃЌЫЕУїИУЗДгІЕФІЄH<0
B. ЖЦЭЬњжЦЦЗЖЦВуЪмЫ№КѓЃЌЬњжЦЦЗБШЪмЫ№ЧАИќШнвзЩњат
C. N2(g)ЃЋ3H2(g) ![]() 2NH3(g)ЁЁІЄH<0ЃЌЦфЫћЬѕМўВЛБфЪБЩ§ИпЮТЖШЃЌЗДгІЫйТЪv(H2)КЭH2ЕФЦНКтзЊЛЏТЪОљдіДѓ
2NH3(g)ЁЁІЄH<0ЃЌЦфЫћЬѕМўВЛБфЪБЩ§ИпЮТЖШЃЌЗДгІЫйТЪv(H2)КЭH2ЕФЦНКтзЊЛЏТЪОљдіДѓ
D. ЫЎЕФРызгЛ§ГЃЪ§KWЫцзХЮТЖШЕФЩ§ИпЖјдіДѓЃЌЫЕУїЫЎЕФЕчРыЪЧЗХШШЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNaЁЂMgЁЂAlЁЂFeЫФжжН№ЪєжаСНжжзщГЩЕФЛьКЯЮя12gЃЌгызуСПбЮЫсЗДгІЗХГіH2 0.5 gЃЈБъзМзДПіЃЉЃЌдђЛьКЯЮяжаБиЖЈКЌгаЕФН№ЪєЪЧ
A.ФЦB.УОC.ТСD.Ьњ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com