
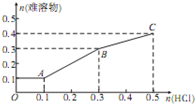
 将0.1mol A12O3、0.1mol SiO2和一定量的Fe2O3、NaOH的固体混合物溶于水,充分反应后,向所得反应体系中缓缓通人0.5mol HC1气体,所得难溶物的物质的量与HC1的物质的量的关系如图所示.下列说法正确的是( )
将0.1mol A12O3、0.1mol SiO2和一定量的Fe2O3、NaOH的固体混合物溶于水,充分反应后,向所得反应体系中缓缓通人0.5mol HC1气体,所得难溶物的物质的量与HC1的物质的量的关系如图所示.下列说法正确的是( )| A、Fe2O3、NaOH的物质的量分别是0.1mol、0.5mol |
| B、结合H+的能力:SiO32->AlO2- |
| C、A点溶液呈碱性,B、C两点溶液呈中性 |
| D、当n(HCl)>0.5mol时,难溶物的量会继续增多 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 组合 分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 纯碱 | 盐酸 | 烧碱 | 氧化铝 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 氧化铁 | 二氧化氮 |
| C | 苛性钠 | 石炭酸 | 硫酸铵 | 过氧化钠 | 二氧化硅 |
| D | 苛性钾 | 硬脂酸 | 小苏打 | 氧化钙 | 五氧化二磷 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(CH3COOH) |
| A、加少量烧碱溶液 |
| B、加入金属锌 |
| C、加少量冰醋酸 |
| D、加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、448mL |
| B、672mL |
| C、896mL |
| D、224mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol?L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13.6g |
| B、12g |
| C、6g |
| D、3.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
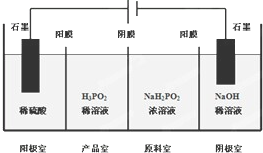 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
| C、如果苯酚浓液沾到皮肤上,应立即用酒精洗 |
| D、配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com