
| A. | Fe2+、Na+、Cl-、SCN- | B. | Na+、Cu2+、NO3-、Cl- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Al3+、Na+、Cl-、NH3•H2O |
分析 A.亚铁离子为有色离子,不满足溶液无色的条件;
B.铜离子为有色离子,不满足溶液为无色的要求;
C.四种离子之间不发生反应,能够共存;
D.铝离子与一水合氨反应生成氢氧化铝沉淀.
解答 解:A.Fe2+为有色离子,不满足溶液无色的要求,故A错误;
B.Cu2+为有色离子,不满足溶液无色的条件,故B错误;
C.Na+、H+、NO3-、SO42-之间不反应,在溶液中能够大量共存,故C正确;
D.Al3+、NH3•H2O之间反应生成氢氧化铝沉淀,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.


科目:高中化学 来源: 题型:解答题
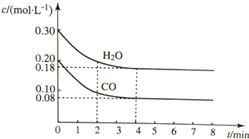 在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.
在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.| t/min | c(CO)/(mol•L-1) | c(H2O)/(mol•L-1) | c(CO2)/(mol•L-1) | c(H2)/(mol•L-1) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 1 | 0.138 | 0.238 | 0.062 | 0.062 |
| 2 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.084 |
| 6 | 0.096 | 0.266 | 0.104 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锡铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锌铁制品则相反 | |
| C. | 将纯水加热至较高温度,K变大、pH变小、呈酸性 | |
| D. | 给0.1mol•L-1CH3COOH溶液中加热,则c(H+)与c(CH3COOH)的比值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


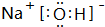 ; 用电子式表示G与Q形成化合物的过程
; 用电子式表示G与Q形成化合物的过程 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
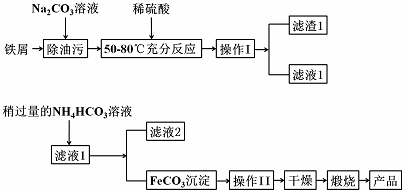
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaCl配成一定物质的量浓度溶液 | B. | HCl溶于水 | ||
| C. | 水变成水蒸气 | D. | (NH4)2CO3加强热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
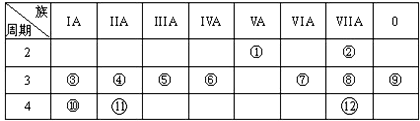
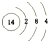 ,写出①的气态氢化物分子的电子式
,写出①的气态氢化物分子的电子式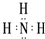 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
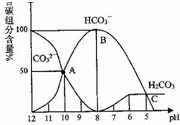 常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )
常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )| A. | 在滴有酚酞的Na2CO3溶液中逐滴加盐酸至溶液恰好变为无色,得到溶液 | |
| B. | 有CO2气体放出的范围是pH≤5 | |
| C. | HCO3-的电离平衡常数为1×10-4 | |
| D. | pH=11的Na2CO3溶液稀释到体积为原来的100倍后pH=9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com