
| A. | 3mo/L | B. | 1.5mo/L | C. | 2mo/L | D. | 4mo/L |
分析 加入过量的铁粉,产生的气体有氢气和一氧化氮,金属离子是亚铁离子,根据电子得失守恒,可得2n(Fe)=3n(NO)+2n(H2),由此分析解答.
解答 解:n(NO)+n(H2)=$\frac{672×1{0}^{-3}L}{22.4L/mol}$=0.03,根据电子得失守恒,而稀硝酸浓度2mo/L,所以10mL混合酸生成一氧化氮的物质的量为2mo/L×0.01L=0.02mol,所以n(H2)=0.01mol,根据电子得失守恒:2n(Fe)=3n(NO)+2n(H2),n(Fe)=0.04mol,c(Fe2+)=$\frac{0.04mol}{0.01L}$=4mo/L,故选:D.
点评 本题考查混合物的计算,题目难度中等,注意铁过量,根据n(H+)、n(NO3-)判断生成气体为NO和H2的混合物.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )
铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )| A. | 放电时,电解质溶液中H2SO4的浓度将变大 | |
| B. | 放电时,正极反应式为:Pb+SO42--2e-=PbSO4 | |
| C. | 放电后用如图所示装置充电,电解质溶液中H+移向左边(PbO2极) | |
| D. | 用如图所示装置充电,阳极反应式为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
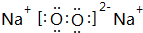 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +(n-18) | B. | -n | C. | -(n+18) | D. | +(18-n) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+═2Fe3++2Cl- | |
| B. | 大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | NaOH溶液中通入过量SO2气体:SO2+2OH-═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2molSO2、0.1 molO2,1.8molSO3,达到新平衡时SO3转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ | |
| B. | 钠与硫酸铜溶液反应:2Na+2Cu2+═2Na++Cu | |
| C. | Cl2通入NaOH溶液:Cl2+2OH-═Cl-+CLO-+H2O | |
| D. | 氧化铜溶于硫酸:O2-+2H+═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com