
| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液。 | _________________。 | 说明:假设②不成立,假设①或③成立;反应的离子方程式是_____________。 |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液。 | 溶液紫红色退去 | 说明:________________________。 |
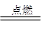 2FeCl3(2分)
2FeCl3(2分)| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| | 溶液中出现红色。(1分) | Fe3++3SCN-=" " Fe(SCN)3。(1分) |
| | | 假设②或③成立(1分) |


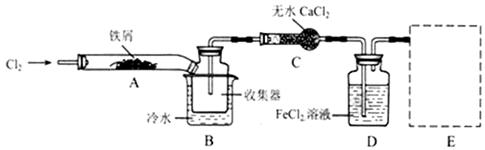
科目:高中化学 来源:不详 题型:填空题
 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
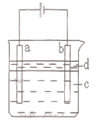
| A.a电极发生的电极反应:4OH--4e-=O2↑+2H2O |
| B.为了在较短时间内看到白色沉淀,可适当加大电压 |
| C.c可以是氯化钠溶液,d可以是苯 |
| D.为了在较短时间内看到白色沉淀,可以剧烈地搅拌溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.韧性比生铁好 | B.在冷的浓硫酸中钝化 |
| C.不能与盐酸反应 | D.在冷的浓硝酸中钝化泛使用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
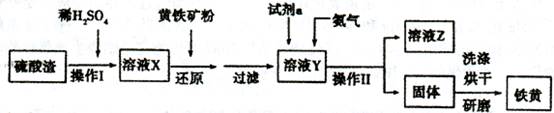
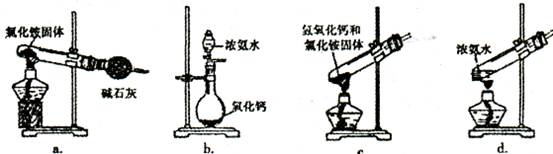
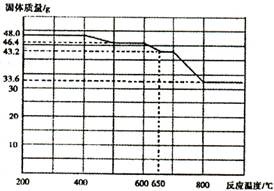
| 加入试剂 | 现象 | 结论 |
| | | 则还原产物为 |
| | | |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁恰好将Fe3+全部还原 |
| B.往反应后溶液中滴入KSCN溶液,不显红色 |
| C.溶液变为浅绿色 |
| D.Fe2+和Fe3+物质的量之比为6:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
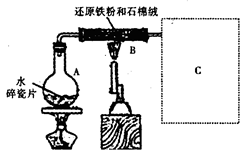
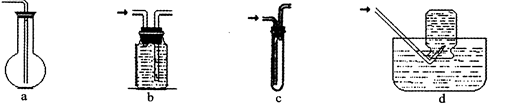
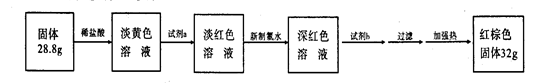
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com