
A、该氖原子的相对原子质量可以表示为
| ||
| B、该氖原子的相对原子质量可以表示为aNA | ||
C、W g该氖原子的物质的量一定是
| ||
| D、12b=NA |
| 1个原子质量 | ||
1个12C原子质量×
|
| m |
| M |
| 1个原子质量 | ||
1个12C原子质量×
|
| ag | ||
|
| 12a |
| b |
| Wg |
| aNAg/mol |
| W |
| aNA |
| 12 |
| b |


科目:高中化学 来源: 题型:

| A、上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),如配制100 mL这种H2SO4溶液,则需要18.4 mol?L-1的浓硫酸约为49.9mL |
| B、加入氧化剂H2O2后,只有Fe(OH)3沉淀出现,若溶液中c(Fe3+)=2.6×10-15mol?L-1,则溶液中c(Cu2+)≤2.2×10-4mol?L-1 |
| C、若加入NH4HCO3后生成的沉淀是Zn5(OH)6(CO3)2,则该反应为5ZnSO4+10NH4HCO3=Zn5(OH)6(CO3)2↓+5(NH4)2SO4+8CO2↑+2H2O |
| D、若生成的沉淀是形态均为Zna(OH)b (CO3)c的(a、b、c都是正整数)两种碱式碳酸锌的混合物,则分别可能是Zn5(OH)6(CO3)2 与Zn3(OH)6CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①③④ |
| C、②③④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ?mol-1 |
| C、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| D、在101 kPa时,2gH2完全燃烧生成液态水,放出285.8lkJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2 g |
| B、25.2 g |
| C、16.8 g |
| D、33.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,4.48L水中含有的分子数目为0.2NA |
| B、0.1mol钠与足量水反应转移的电子数目为0.1NA |
| C、0.2mol?L-1CuSO4溶液中含有的SO42-离子数目为0.2NA |
| D、0.5molKClO3中含有Cl-的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
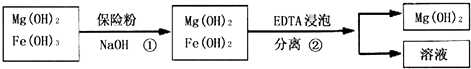
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com