
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+与D2-的核外电子数相等 | |
| B. | B与E形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 原子的失电子能力:C>A | |
| D. | 单质与浓度相等的稀盐酸反应的速率为B>A |
分析 元素的最高正价=最外层电子数,最高正价和最低负价绝对值的和为8,D、E两元素最外层电子数为6,故为第ⅥA元素,而D的半径大于E,E为没有最高正价,则E为O元素,D为S元素;
B元素最外层电子数为3,为B或Al,但是半径比氧和硫均大,故位于氧元素和硫元素的中间,应为Al;
A的半径比铝大,最外层电子数为2,应为Mg,C的半径比Mg小,最外层两个电子,故为Be,然后根据各种元素的原子在周期表中的分布位置确定它们的性质递变规律.
解答 解:元素的最高正价=最外层电子数,最高正价和最低负价绝对值的和为8,D、E两元素最外层电子数为6,故为第ⅥA元素,而D的半径大于E,E为没有最高正价,则E为O元素,D为S元素;B元素最外层电子数为3,为B或Al,但是半径比氧和硫均大,故位于氧元素和硫元素的中间,应为Al;A的半径比铝大,最外层电子数为2,应为Mg,C的半径比Mg小,最外层两个电子,故为Be.
A、A2+是镁离子,D2-是硫离子,它们的核外电子数分别是10和18,核外电子数不相等,故A错误;
B、B与E形成的化合物是氧化铝,属于两性氧化物,既能与强酸反应又能与强碱反应,故B正确;
C、同主族,从上到下原子得失电子能力逐渐增强,所以失电子能力Mg>Be,故C错误;
D、同周期,从左到右金属性逐渐减小,单质与浓度相等的稀盐酸反应的速率逐渐减小,则速率:A>B,故D错误.
故选B.
点评 本题主要考查了学生有关元素周期表的应用知识,注意根据化合价及原子半径来推断元素是解题的关键,要熟记元素周期表中的递变规律,学以致用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
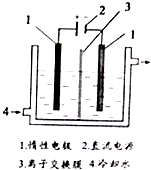 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
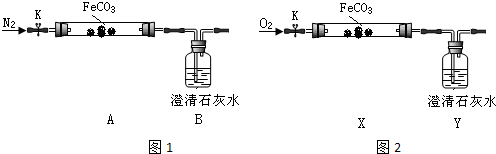
| 实验编号 | 实验步骤 | 实验现象 |
| i | 向甲溶液滴加KSCN溶液 | 溶液变红色 |
| ii | 向乙溶液滴加酸性高锰酸钾溶液 | 溶液不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 左下方区域的金属元素 | B. | 金属和非金属分界线附近的元素 | ||
| C. | 过渡元素 | D. | 稀有气体元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成 | |
| B. | 离子化合物中一定有金属元素和非金属元素 | |
| C. | 全部由非金属元素形成的化合物一定是共价化合物 | |
| D. | 共价化合物中各原子都一定满足最外层8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
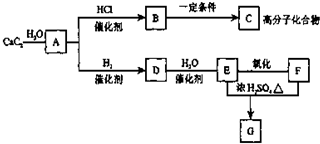 根据如图,回答问题.
根据如图,回答问题. ,GCH3COOCH2CH3
,GCH3COOCH2CH3查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com