
���淴Ӧ2NO2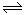 2NO+O2�����������ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��
2NO+O2�����������ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��
�ٵ�λʱ��������n molO2��ͬʱ����2n mol NO2
����NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬
�ۻ���������ɫ���ٸı��״̬
�ܻ��������ܶȲ��ٸı��״̬
�ݻ�������ƽ����Է����������ٸı��״̬
A���٢ۢ� B���ڢۢ� C���٢ۢ� D���٢ڢۢܢ�
 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�������ʡ����������ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ͼ��ʾת����ϵ(X����±��)��˵������ȷ��( )
A��H2(g)+X2(g) = 2H(g)+2X(g) ��H2>0
B����X �ֱ��ʾCl��Br��I������̢����յ��������μ���
C������HX�ķ�Ӧ����;���йأ����ԡ�H1�١�H2+��H3
D��Cl2��Br2 �ֱ�����Ӧ��ͬһ�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2����K1>K2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����У����������ѧ�Ծ��������棩 ���ͣ������
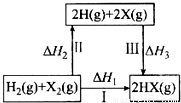
�о���Ԫ�ؼ��仯��������ʾ�����Ҫ����
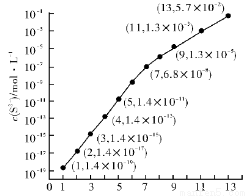
��1��25 �棬��0.10 mol • L-1HA��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c(S2-)��ϵ����ͼ(������Һ����ı仯��H2S�Ļӷ�����
��pH��11 ʱ����Һ�е� c(H2S)+c(HS-)= mol•L-1��������3λ��Ч���֣�
��ij��Һ��0.010 mol • L-1 Fe2+��δ֪Ũ�ȵ�Mn2+��0.10 mol•L-1H2S������ҺpH�� ʱ��Fe2+��ʼ��������Mn2+��ʼ����ʱ����Һ��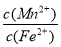 = ��
= ��
[��֪��Ksp(FeS)��1.4��10-19��Ksp(MnS)=2.8��10-13]
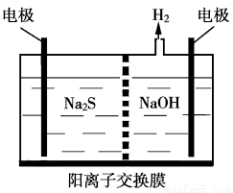
��2�������ת������Դ���úͻ�����������Ҫ�о����⡣�������������ж��ַ���������һ���ǽ��ռ�����H2S�����Һ���뵽��ͼ��ʾ�ĵ��� �����������е�⡣��д�������ĵ缫��Ӧʽ ��ͬʱ������������(n��1)S+S2-��Sn2-����������������Һ��ϡ�����ữ����������ɫ���ǣ������ӷ���ʽΪ ��
��3��25�棬������ĵ���ƽ�ⳣ�����±���
Ka | Ka2 | |
H2SO3 | 1.3X10-2 | 6.3X10-8 |
H2CO3 | 4.2X10-7 | 5.6X10-11 |
ʵ���ҳ��ñ���NaHCO3��Һ��ȥCO2��������SO2����д��SO2��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽ ��[
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����У����������ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A����֪�����ۻ���Ϊ6.0 kJ • mol-1�������������Ϊ20 kJ • mol-1������1 mol ������2 mol��������ۻ�����ȫ�����ƻ���������������ֻ���ƻ�����15 %�����
B����֪һ���¶��£�������Һ�����ʵ���Ũ��Ϊc�������Ϊa, ���볣��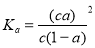 ������ˮϡ�ͣ���CH3COOH
������ˮϡ�ͣ���CH3COOH CH3C00-+H+�����ƶ���a���� Ka����
CH3C00-+H+�����ƶ���a���� Ka����
C������ı�ȼ����Ϊ-890.3 kjJ• mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��
CH4(g)+2O2(g)��CO2(g)+2H2O��1�� ��H=-890.3 kJ • mol-1
D��500�桢30 MPa�£���0.5 mol N��1.5 mol H2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3 kJ�����Ȼ�ѧ����ʽΪ��
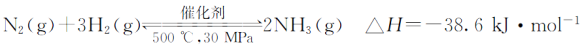
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������и�һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A�����ȷ�Ӧ��һ������Ҫ���ȣ������ȷ�Ӧһ����Ҫ����
B�� �кͷ�Ӧ���Ƿ��ȷ�Ӧ
C������ȼ�շų��������ȣ�˵���μӷ�Ӧ��������������������������ˮ����������
D��C��CO2��Ӧ�����ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������и�һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ����������ԭ��Ӧ���������ȷ�Ӧ����
A����Ƭ��ϡ���ᷴӦ
B��Ba(OH)2��8H2O��NH4Cl�ķ�Ӧ
C�����ȵ�̿��CO2��Ӧ
D��������O2�е�ȼ�շ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������и�һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������е�����Ԫ�ؿ����γ�ԭ�Ӹ�����Ϊ2:3�Ļ������������Ԫ�ص�ԭ������֮�������
A��1 B��3 C��5 D��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���л�ѧ��Ӧ�У��������Ӽ������Լ����Ǽ��Լ����ѣ��������Ӽ������Լ����Ǽ��Լ��γɵ���
A��2Na2O2+2H2O=4NaOH+O2��
B��MgCl2+2NaOH=Mg(OH)2��+2NaCl
C��2NaOH +Cl2 = NaOCl +H2O
D��NH4Cl+NaOH=NaCl+NH3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������������ѧ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й���﨣�Rb������������ȷ���ǣ� ��
A����λ�����ڱ��ĵ������ڡ��ڢ�A��
B�����ơ��ء�����ֵ����У���ͬ���������ˮ�ķ�Ӧ������С
C���������������
D������������ӻ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com