
下列有关化学用语表示正确的是( )。
A.CO2的电子式: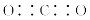
B.质子数为43、中子数为56的Tc原子:
C.Cl-的结构示意图:
D.氨基乙酸的结构简式:
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.1元素周期表练习卷(解析版) 题型:选择题
如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素可能位于( )。
A.ⅢA或ⅢB B.ⅣA C.ⅠB D.ⅠA
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )。

A.X为直流电源的负极,Y为直流电源的正极
B.图中的b>a
C.阳极区pH增大
D.该过程中的产品主要为H2SO4和H2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:选择题
T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g) Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )。
A.反应在前2 s 的平均速率v(CO)=0.080 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(Cl2)=0.11 mol·L-1,则反应的ΔH<0
C.T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2 和0.10 mol CO,反应达到平衡前v正>v逆
D.T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80%
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是( )。
A.5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA
B.常温常压下,1 mol氦气含有的核外电子数为4NA
C.7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA
D.0.5 mol雄黄(As4S4,结构如图)含有NA个S—S键

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(解析版) 题型:填空题
用石灰乳、石灰氮(CaCN2)和炼厂气(含H2S)反应,既能净化尾气,又能获得应用广泛的CS(NH2)2(硫脲),其部分工艺流程如下:

(1)高温下,H2S存在下列反应:2H2S(g)??2H2(g)+S2(g),其平衡常数表达式为K=________________。
(2)用石灰乳吸收H2S制取Ca(HS)2需要在低温下进行,其原因是_____________________________________________________;
过滤得到的滤渣可再利用,滤渣的主要成分是________(填化学式)。
(3)合成硫脲需长时间搅拌,并在较高温度(80~85 ℃)下进行,其目的是_______________________________________。
Ca(HS)2与CaCN2在水溶液中合成硫脲的化学方程式为________________________________。
(4)化合物X与硫脲互为同分异构体,X加入FeCl3溶液中,溶液显红色,X的化学式为________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(解析版) 题型:选择题
下列说法符合绿色化学思想的是( )。
A.对工业生产硝酸产生的废气、废水进行严格处理
B.利用根瘤菌固氮以减少氮肥生产厂
C.实验室制备NO2时在通风橱内进行
D.生产硫酸的工厂种草、种树,使其成为“花园式工厂”
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第7讲水溶液中的离子平衡练习卷(解析版) 题型:填空题
25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol·L-1的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是______________(填编号);
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是________;
A.c(H+) B. C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000 mL,稀释过程pH变化如图:则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是__________________________________________,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:____________________________________;

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填准确数值)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第4讲物质结构元素周期律练习卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/10-12 m | 160 | 110 | 70 | 66 |
主要化合价 | +2 | +5、+3、-3 | +5、+3、-3 | -2 |
下列叙述正确的是( )。
A.离子半径:W<X
B.气态氢化物的稳定性:Z>W
C.化合物X3Z2中既含有离子键又含有共价键
D.最高价氧化物对应水化物的酸性:Z>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com