
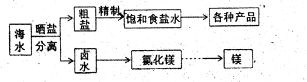
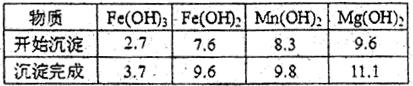
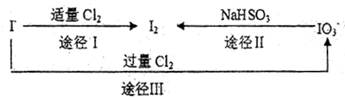
科目:高中化学 来源:不详 题型:填空题
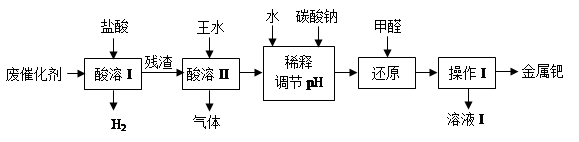
 3H2PdCl4 + 2NO↑+ 4H2O
3H2PdCl4 + 2NO↑+ 4H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 |
| B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” |
| C.废电池需回收,主要是要利用电池外壳的金属材料 |
| D.升高温度可降低活化能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.利用太阳能等清洁能源代替化石燃料,有利于节约资源.保护环境 |
| B.凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D.几千万年前地球上一条恐龙体内的某个原子可能在你的身体里 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Br2是氧化产物 | B.氯气是还原剂 |
| C.氯气是氧化剂 | D.该反应属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇(分子式为CH3OH)。“绿色自由”构想技术流程如下:
科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇(分子式为CH3OH)。“绿色自由”构想技术流程如下: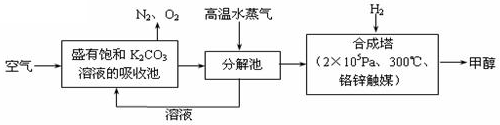
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热分解法、热还原法、电解法 | B.热还原法、热分解法、电解法 |
| C.电解法、热还原法、热分解法 | D.电解法、热分解法、热还原法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com