
在恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个带有理想活塞(即无质量、无摩擦力的刚性活塞)的体积可变的密闭容器,两容器起始状态完全相同,都充有C气体,若发生可逆反应C(g)⇌A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡.下列说法中正确的是( )
|
| A. | 平衡时C的转化率:乙>甲 | B. | 平衡时C的体积分数:乙>甲 |
|
| C. | 反应速率:乙>甲 | D. | 平衡时A的物质的量:甲>乙 |
考点:
化学平衡建立的过程.
专题:
化学平衡专题.
分析:
甲为恒容,乙为恒压,随着反应的进行,甲容器压强逐渐增大,而增大压强,平衡向逆方向移动,本题可从压强对平衡移动的影响的角度比较分析.
解答:
解:甲为恒容,乙为恒压,随着反应的进行,甲容器压强逐渐增大,而乙压强不变,
A.增大压强平衡向逆方向移动,C的转化率减小,则平衡时C的转化率:乙>甲,故A正确;
B.增大压强平衡向逆方向移动,平衡时C的体积分数:甲>乙,故B错误;
C.压强越大反应速率越大,则反应速率:甲>乙,故C错误;
D.增大压强平衡向逆方向移动,则平衡时A的物质的量:乙>甲,故D错误.
故选A.
点评:
本题考查化学平衡的移动,题目难度不大,本题注意从压强对平衡移动的影响的角度比较甲乙两个状态.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
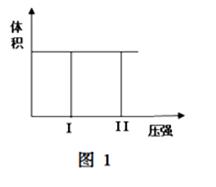
( I) 在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g)  2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,
pC(g) ,
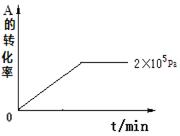
在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如
下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
⑴当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
⑵维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.
⑶当压强为1×106 Pa时,此反应的平衡常数表达式: 。
⑷其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是 ( )
| 编号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 强酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
A.①③ B.②③
C.①④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=﹣Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=﹣Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)△H=﹣Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
|
| A. | Q1>Q2>Q3 | B. | Q1>Q3>Q2 | C. | Q3>Q2>Q1 | D. | Q2>Q1>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
发射卫星用N2H4作燃料,NO2作氧化剂,两者反应生成N2和水蒸气,
已知:N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJ/mol
试写出N2H4与 NO2反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
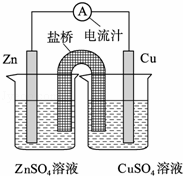
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
|
| A. | 构成原电池,锌片作正极 |
|
| B. | 锌片上有铜析出,铜片上没有 |
|
| C. | 铜片附近Cu2+离子浓度减小 |
|
| D. | 盐桥(琼脂﹣饱和KCl溶液)中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
|
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
|
| C. | 用0.2000mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和 |
|
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或实验原理的说法中正确的是()
A.  用如图装置进行蒸馏实验
用如图装置进行蒸馏实验
B.  用如图装置吸收氯化氢气体
用如图装置吸收氯化氢气体
C.  用酒精提取溴水中的溴
用酒精提取溴水中的溴
D.  用如图装置灼烧小苏打制取少量的苏打
用如图装置灼烧小苏打制取少量的苏打
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com