
【题目】(1)写出石英主要成分的化学式:_____________;写出异丁烷的结构简式:_____________
(2)联氨(又称为肼,分子式为N2H4)一种高能燃料,常备用于火箭、航天领域,通常用过量NH3与NaClO反应制得。
①请写出NH3的电子式:________________________
②肼溶于水显弱碱性,其原理与氨相似。请用电离方程式解释肼的水溶液显碱性的原因是:________
③请写出上述制备肼的化学方程式:______________________________________________________
【答案】SiO2 CH3CH(CH3)2  N2H4·H2O
N2H4·H2O![]() OH-+N2H
OH-+N2H![]() 2NH3+NaClO=NaCl+N2H4+H2O
2NH3+NaClO=NaCl+N2H4+H2O
【解析】
根据化合价升降法书写氧化还原方程式,运用类比的方法推测肼在水中呈碱性的原因,并写出相应的电离方程式。
(1)石英的主要成分的化学式是SiO2,异丁烷的结构简式为CH3CH(CH3)2;
(2)①NH3中N原子最外层有5个电子,其中3个为单电子,分别与3个H原子最外层的电子共用形成3个N-H共价键,故NH3的电子式为 ;
;
②氨溶于水发生反应生成一水合氨,一水合氨在水中电离生成铵根离子和氢氧根离子,所以氨的水溶液呈碱性,由于肼的性质与氨相似,则肼也可以和水反应生成一水合肼,一水合肼可以电离出![]() 和OH-,则肼的水溶液呈碱性的原因用电离方程式解释为N2H4·H2O
和OH-,则肼的水溶液呈碱性的原因用电离方程式解释为N2H4·H2O![]() OH-+
OH-+![]() ;
;
③NH3可以与NaClO发生氧化还原反应,生成N2H4和NaCl,反应过程中NaClO中1个ClO-得到2个电子生成Cl-,NH3中1个N原子失去1个电子生成N2H4,根据得失电子守恒,2个NH3失去2个电子转移给NaClO才可以发生守恒,结合原子守恒,制备肼的化学方程式为2NH3+NaClO=NaCl+N2H4+H2O。


科目:高中化学 来源: 题型:
【题目】(1)物质X的产量通常用来衡量一个国家的石油化工水平。以X为主要原料合成重要的有机化合物路线如下图所示,请回答下列问题。

(1)X所含官能团的名称是______________,A物质所含官能团的名称是________。
(2)反应③的化学方程式是_______________,以乙烯为原料可合成有机高分子化合物D,反应①的化学方程式是____________________,该反应属于______反应(填有机反应类型)。
(3)下列物质中,不能通过乙烯加成反应得到的是________(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
(4)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是______。
②实验开始时,试管b中的导管不伸入液面下的原因是______。
③反应结束后,将试管b中的混合液经过____(填写实验分离操作)可得到纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铜片中加入某浓度的硫酸120ml,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500ml。再加入足量锌粉,使之充分反应,收集到标准状况下氢气2.24L,过滤残留固体,干燥后称量,质量减轻了7.50g。求:
(1)溶解的铜的质量。______
(2)原硫酸的物质的量浓度。(要求写出简要计算过程)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于测定1mol氢气体积的操作中错误的是( )
A. 镁带称量后,用砂皮擦去表面的氧化层B. 保证装置不漏气
C. 用针筒注入硫酸后,拔出速度要快D. 镁带的质量要使产生的氢气足以计量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲醇(CH3OH)制备一些高附加值产品,是目前研究的热点。
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ. CH3OH(g)+H2O(g)![]() 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1
反应Ⅱ. H2(g)+CO2(g)![]() H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1
反应Ⅲ. CH3OH(g)![]() 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1
反应Ⅳ. 2CH3OH(g)![]() 2H2O(g)+C2H4(g) △H4= c kJ·mol-1
2H2O(g)+C2H4(g) △H4= c kJ·mol-1
①△H1=______kJ·mol-1 。
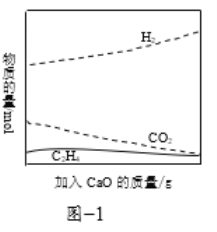
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,请分析加入CaO提高氢气产率的原因:______。
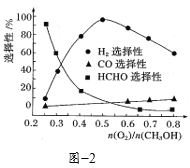
③在一定条件下用氧气催化氧化甲醇制氢气,原料气中![]() 对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制![]() =______,当
=______,当![]() = 0.25时,CH3OH和O2发生的主要反应方程式为______。
= 0.25时,CH3OH和O2发生的主要反应方程式为______。
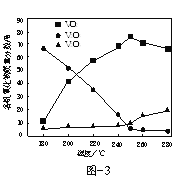
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1000kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是______。
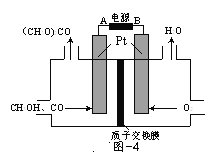
(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。
①电源的负极为______(填“A”或“B”)。
②阳极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C物质为烃类,在标准状况下的密度为1.16g/L,F物质具有水果香味,G物质不能水解。转化关系如图所示,省略了反应条件。

请回答下列问题:
(1)写出G的分子式:____________________。
(2)D中官能团的名称是__________________________。 C→A的反应类型____________
(3)请写出反应B+E→F的化学方程式:______________________。
(4)下列有关说法正确的是_____________________________。
A.C物质燃烧时,易产生大量黑烟 B.物质B和甘油( )互为同系物
)互为同系物
C.一定条件下,A可被直接氧化为D D.用NaOH溶液可以区分B、D、F
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程如图所示。下列说法正确的是( )
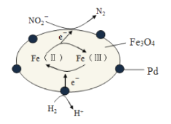
A.Pd作正极
B.Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被Fe(Ⅱ)氧化为N2
D.用该法处理后水体的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变某醋酸溶液的pH,溶液中c(CH3COO-)与c(CH3COOH)之和始终为0.1mol·L-1,溶液中H+、OH-、CH3COO-及CH3COOH浓度的常用对数值(lgc)与pH的关系如图所示。下列说法错误的是( )

A.图中③表示lgc(H+)与pH的关系曲线
B.0.1mol·L-1CH3COOH溶液的pH约为2.88
C.lgK(CH3COOH)=4.74
D.向0.10mol·L-1醋酸钠溶液中加入0.1mol醋酸钠固体,水的电离程度变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示.下列有关说法正确的是( )

A.0.1mol/LNa2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
B.a、b、c三点对应的溶液中,水的电离程度最大的为b点
C.该温度下,Ksp(CuS)的数量级为10-36
D.向10 mL Ag+、Cu2+物质的量浓度均为0.1mol/L的混合溶液中逐滴加入0.01mol/L的Na2S溶液,Cu2+先沉淀[已知:Ksp(Ag2S)=6.4×10-50]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com