
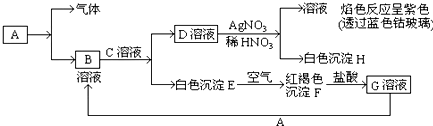
分析 根据题中各物质转化关系,D和硝酸银溶液生成溶液的焰色反应呈紫色,说明有钾离子,有白色沉淀H应为AgCl,所以D为KCl,红褐色沉淀F应为Fe(OH)3,E在空气中被氧化成F,所以E为Fe(OH)2,氢氧化铁与盐酸反应生成G为FeCl3,G与A能生成B,根据元素守恒,结合D和E的组成可知,B为FeCl2,C为KOH,所以可推得A为Fe,据此答题.
解答 解:根据题中各物质转化关系,D和硝酸银溶液生成溶液的焰色反应呈紫色,说明有钾离子,有白色沉淀H应为AgCl,所以D为KCl,红褐色沉淀F应为Fe(OH)3,E在空气中被氧化成F,所以E为Fe(OH)2,氢氧化铁与盐酸反应生成G为FeCl3,G与A能生成B,根据元素守恒,结合D和E的组成可知,B为FeCl2,C为KOH,所以可推得A为Fe,
(1)根据上面的分析可知,C为KOH,H为AgCl,
故答案为:KOH;AgCl;
(2)E为Fe(OH)2,在空气中可以被氧化成氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)G为FeCl3,用KSCN鉴别G溶液的现象为溶液出现血红色,向FeCl3溶液加入Fe的离子反应方程式为Fe+2Fe3+=3Fe2+,
故答案为:溶液出现血红色;Fe+2Fe3+=3Fe2+.
点评 本题主要考查铁及其化合物相互转化,难度不大,解题的关键是根据物质的颜色、状态、焰色反应等特征进行推断,答题时注意化学用语的规范表达.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

 $\stackrel{②}{→}$
$\stackrel{②}{→}$ $\stackrel{③}{→}$Y$\stackrel{④}{→}$
$\stackrel{③}{→}$Y$\stackrel{④}{→}$
| 反应① | 反应② | 反应③ | |
| 试剂及条件 | |||
| 反应类型 |
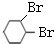 +2NaOH $→_{△}^{醇}$
+2NaOH $→_{△}^{醇}$ 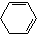 +2NaBr+2H2O
+2NaBr+2H2O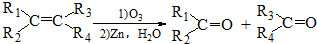 (R1、R2、R3、R4为烃基或H)
(R1、R2、R3、R4为烃基或H) $→_{(2)Zn,H_{2}O}^{(1)O_{3}}$OHC-CH2CH2CHO+OHC-CHO,产物中含氧官能团的名称是醛基,
$→_{(2)Zn,H_{2}O}^{(1)O_{3}}$OHC-CH2CH2CHO+OHC-CHO,产物中含氧官能团的名称是醛基,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBr的稳定性比HI强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8s | B. | 10s | C. | 12s | D. | 14s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ HCO3- NO3- ClO- | B. | Na+ SO32- NH4+ Ba2+ | ||
| C. | Ba2+ S2- Cl- SO42- | D. | AlO2- CO32- Cl- Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.43 kJ | B. | 4.86 kJ | C. | 43.8 kJ | D. | 87.5 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com