
| A. | C9H10O2 | B. | C9H12O2 | C. | C9H16O2 | D. | C9H18O2 |
分析 由题目信息可知B、C均为一元羧酸,直链饱和脂肪酸C组成通式符合CnH2nO2,结合相对分子质量确定C的分子式,A的水解可以表示成:C35H50O6+3H2O→C3H8O3(甘油)+C+2B,再根据原子守恒确定B的分子式.
解答 解:只含酯基的酯类化合物A的化学式为C35H50O6,1mol该酯类化合物A完全水解可得到1mol甘油、2mol不饱和脂肪酸B和1mol直链饱和脂肪酸C,则B、C均为一元羧酸,直链饱和脂肪酸C组成通式符合CnH2nO2,其相对分子质量为228,则n=$\frac{228-32}{14}$=14,故C的分子式为C14H28O2,A的水解可以表示成:C35H50O6+3H2O→C3H8O3(甘油)+C14H28O2+2B,根据原子守恒,则B的分子式为C9H10O2,
故选:A.
点评 本题考查有机物分子式确定、酯的水解,关键是理解酯的水解反应、确定C分子式,再利用原子守恒解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的CH3COOH溶液的pH=2 | B. | CH3COOH溶液中含有CH3COOH分子 | ||
| C. | CH3COOH能与NaOH发生中和反应 | D. | 常温下CH3COONa溶液的pH=8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
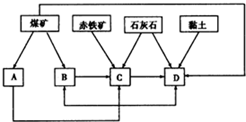 我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土.拟在该地区建设大型炼铁厂.
我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土.拟在该地区建设大型炼铁厂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
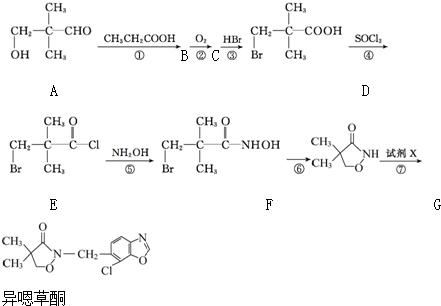
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.
连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
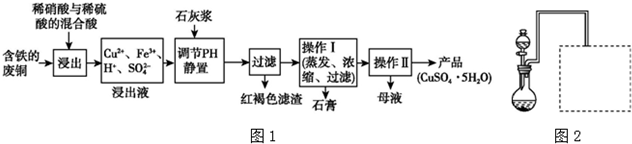
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
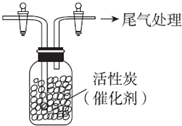 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com