
| A. | 紫色石蕊试液 | B. | Ba(N03)2溶液 | C. | CuCl2溶液 | D. | 焰色反应 |
分析 NaOH溶液为碱性溶液,易与金属离子反应,KCl溶液显中性,利用焰色反应检验钠、钾离子,以此来解答.
解答 解:A.滴定紫色石蕊显蓝色的为NaOH溶液,无现象的为KCl溶液,可鉴别,故A不选;
B.均不与Ba(N03)2溶液反应,现象相同,不能鉴别,故B选;
C.与氯化铜反应生成蓝色沉淀的为NaOH,无现象的为KCl溶液,可鉴别,故C不选;
D.焰色反应为紫色的为KCl,为黄色的为NaOH,现象不同,可鉴别,故D不选;
故选B.
点评 本题考查物质的检验和鉴别,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 35%-40%甲醛溶液俗称为福尔马林,可用来浸泡海产品来起到保鲜效果 | |
| D. | 用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  Y表示原子半径 | B. |  Y表示元素的电负性 | ||
| C. | 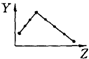 Y表示元素的最高正价 | D. |  Y表示元素的第一电离能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 相关信息 |
| X | 它存在多种同素异形体,可用于制作钻头、电极和纳米材料 |
| Y | 最外层电子数是内层电子数的3倍 |
| Z | 第三周期中最高价氧化物的水化物碱性最强 |
| W | 与X元素处于同一主族,工业上常用X的单质还原W的氧化物制取W单质 |
| A. | 原子子半径:W>Z>Y>X | |
| B. | Y、Z两种元素只能形成化合物Z2Y | |
| C. | 最低价气态氢化物的热稳定性:W>X | |
| D. | 最高价氧化物对应水化物的酸性:X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在放电时,该电池的负极材料是铅板 | |
| B. | 在充电时,铅蓄电池的负极与充电器电源的负极相连 | |
| C. | 在放电时,外电路中电流流向为:正极→外电路→负极 | |
| D. | 在充电时,阳极发生的反应为:PbSO4+2e-═Pb+SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学研究性学习小组,在学习了金属的知识后,探究Cu的常见化合物性质.过程如下:
某校化学研究性学习小组,在学习了金属的知识后,探究Cu的常见化合物性质.过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com