
Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe304+4CO![]() 3Fe+4C02,若有1mol
3Fe+4C02,若有1mol
Fe304参加反应,转移电子的物质的量是 mol.
 (2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
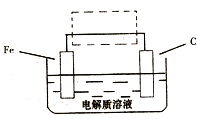
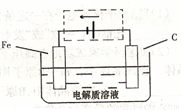
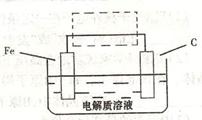
(3)钢铁的电化腐蚀简单示意图如下,将该图稍作修
改即可成为钢铁电化学防护的简单示意图,请在下图虚
线框内作出修改,并用箭头标出电子流动方向。
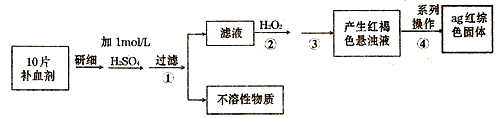
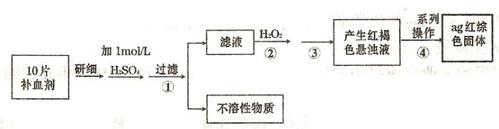
(4)硫酸亚铁晶体(FeS04·7H20)常作医药上的补血剂。课外研究性小组测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
①证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,此过程的现象为:
②若该实验温度下,步骤③中难溶物的溶度积为Ksp=8×l0-38,试计算该物质沉淀完全所需要的pH= (已知溶液中离子浓度小于10-5mol)时,该离子可看做沉淀完全;lg2=0.3)
③步骤④中一系列的操作步骤为:过滤、 、灼烧、冷却、称量。
④若实验过程中无损耗,最后称量得到a克红棕色的固体,则每片补血剂中含铁元素的质
量为 g.(用含a的式子表示)
科目:高中化学 来源: 题型:阅读理解
 (2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
| ||


查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第9讲 金属及其化合物练习卷(解析版) 题型:填空题
Fe元素是地壳中最丰富的元素之一,在金属中含量仅次于铝,铁及其化合物在生活生产中有广泛应用。请回答下列问题。
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO 3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是___________________________________________________。
(3)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。
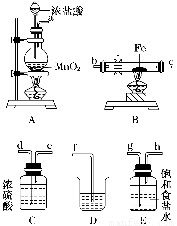
请回答下列问题:
①各装置的正确连接顺序为(填写装置代号)
A→________→________→________→D。
②装置C的作用是_______________________________________________________。
③反应开始后,B中硬质玻璃管内的现象为________;可以检验生成物中含有Fe3+的试剂是________(填写试剂名称)。
查看答案和解析>>
科目:高中化学 来源:2010年山东省临沂市高考化学一模试卷(解析版) 题型:解答题
 3Fe+4C02,若有1mol Fe34参加反应,转移电子的物质的量是______mol;
3Fe+4C02,若有1mol Fe34参加反应,转移电子的物质的量是______mol;

查看答案和解析>>
科目:高中化学 来源:山东省临沂市2010届高三一模(化学) 题型:实验题
Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe304+4CO 3Fe+4C02,若有1mol
3Fe+4C02,若有1mol
Fe304参加反应,转移电子的物质的量是 mol.
 (2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
(3)钢铁的电化腐蚀简单示意图如下,将该图稍作修
改即可成为钢铁电化学防护的简单示意图,请在下图虚
线框内作出修改,并用箭头标出电子流动方向。
(4)硫酸亚铁晶体(FeS04·7H20)常作医药上的补血剂。课外研究性小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
①证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,此过程的现象为:
②若该实验温度下,步骤③中难溶物的溶度积为Ksp=8×l0-38,试计算该物质沉淀完全所需要的pH= (已知溶液中离子浓度小于10-5mol)时,该离子可看做沉淀完全;lg2=0.3)
③步骤④中一系列的操作步骤为:过滤、 、灼烧、冷却、称量。
④若实验过程中无损耗,最后称量得到a克红棕色的固体,则每片补血剂中含铁元素的质
量为 g.(用含a的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com