
分析 (1)生成KClO3时,Cl元素的化合价由0升高为+5价,化合价升高时生成氧化产物;
(2)根据电子守恒来配平化学方程式,并根据化合价的升降来标出电子转移情况;
(3)据化学方程式分析;
(4)KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3H2O+3Cl2↑中,Cl元素的化合价由+5价 降低为0,Cl元素的化合价由-1价升高为0,以此来解答.
解答 解:(1)氯气生成KClO3,Cl元素化合价升高生成氧化产物,故答案为:氧化产物;
(2)氯气与KOH反应生成KCl和KClO3,据电子守恒写出化学方程式为3Cl2+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O,每生成5molKCl同时生成1molKClO3转移5mol电子,
故答案为:3Cl2+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O;5mol;
(3)氯气与KOH反应的化学方程式为化学方程式为3Cl2+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O,每生成5molKCl和1molKClO3转移5mol电子,同时消耗6molKOH,若反应中有1mol电子发生转移,则参加反应的KOH 是$\frac{6}{5}$mol=1.2mol,故答案为:1.2mol;
(4)A、KCl中Cl元素化合价在反应前后没有变化,故A错误;
B、HCl在反应中即是还原剂同时也表现了酸性,因为生成KCl,故B错误;
C、Cl元素的化合价由+5价 降低为0,Cl元素的化合价由-1价升高为0,反应中转移的电子数为5,故C错误;
D、HCl是还原剂,氯气是还原产物,所以还原性:HCl>Cl2,故D正确;
故答案为:D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念及转移电子计算,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
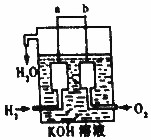 氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题
氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:推断题
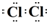 ,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
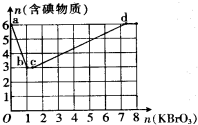 近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应:
近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 12 | C. | 18 | D. | 24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com