
分析 (1)一水合氨为弱电解质,不能完全电离,稀释前c(OH-)NaOH溶液大于氨水,若稀释后溶液pH相等,则氢氧化钠稀释体积大于一水合氨;
(2)A.向水中加入NaHSO4固体,溶液中c(H+)增大,抑制水电离;
B.向水中加NaHCO3固体,碳酸氢根离子水解生成碳酸,促进水电离;
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1],促进水电离,但溶液仍然呈中性;
D.向水中加入NH4Cl固体,铵根离子水解促进水电离,导致溶液中c(H+)增大;
(3)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-pH}}$;在pH=3的CH3COOH 溶液中,水电离出来的c(H+)=$\frac{1{0}^{-14}}{1{0}^{-pH}}$;
(4)NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性,结合电荷守恒判断溶液中离子浓度大小;
(5)一水合氨是弱电解质,部分电离;醋酸根离子促进铵根离子水解、氢离子抑制铵根离子水解,铵根离子水解程度越大,溶液中NH4+浓度越小;
(6)t℃时,Kw=1×10-12,在该温度时,pH=9的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-9}}$mol/L=0.001mol/L,
pH=2的H2SO4溶液中c(H+)=0.01mol/L,混合溶液pH=3,混合溶液中c(H+)=0.001mol/L,
混合溶液中c(H+)=$\frac{0.01×b-0.001a}{a+b}$mol/L=0.001mol/L.
解答 解:(1)一水合氨为弱电解质,不能完全电离,稀释前c(OH-)NaOH溶液大于氨水,如果稀释相同的倍数,pH氢氧化钠大于氨水,若要使稀释后溶液pH相等,则氢氧化钠稀释体积大于一水合氨,即m>n,故答案为:>;
(2)A.向水中加入NaHSO4固体,溶液中c(H+)增大,抑制水电离,平衡逆向移动,故A错误;
B.向水中加NaHCO3固体,碳酸氢根离子水解生成碳酸,促进水电离,平衡正向移动但溶液呈碱性,故B错误;
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1],促进水电离,但溶液仍然呈中性,故C错误;
D.向水中加入NH4Cl固体,铵根离子水解促进水电离,平衡正向移动,导致溶液中c(H+)增大,溶液呈酸性,故D正确;
故选D;
(3)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-pH}}$=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3 mol/L;在pH=3的CH3COOH 溶液中,水电离出来的c(H+)=$\frac{1{0}^{-14}}{1{0}^{-pH}}$=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11 mol/L,
故答案为:10-3 mol/L;10-11 mol/L;
(4)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(OH-)<c(H+),溶液中存在电荷守恒,根据电荷守恒得c(NH4+)+cH+)=c(Cl-)+c(OH-),所以得c(NH4+)<c(Cl-),铵根离子水解程度较小,所以溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(5)一水合氨是弱电解质,部分电离;醋酸根离子促进铵根离子水解、氢离子抑制铵根离子水解,铵根离子水解程度越大,溶液中NH4+浓度越小,所以相同浓度的这几种溶液中铵根离子浓度大小顺序是⑧>⑥>⑦>⑨,
故答案为:⑧>⑥>⑦>⑨;
(6)t℃时,Kw=1×10-12,在该温度时,pH=9的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-9}}$mol/L=0.001mol/L,
pH=2的H2SO4溶液中c(H+)=0.01mol/L,混合溶液pH=3,混合溶液中c(H+)=0.001mol/L,
混合溶液中c(H+)=$\frac{0.01×b-0.001a}{a+b}$mol/L=0.001mol/L,a:b=9:2,
故答案为:9:2.
点评 本题考查了离子浓度大小比较、水的电离及其影响因素、弱电解质的电离平衡等知识,题目难度较大,试题涉及的题量较大,充分考查了学生对所学知识的掌握情况,明确溶液中水电离的氢离子浓度大小的计算方法,为易错点.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: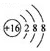 | |
| B. | 原子核内有10个质子的氧原子${\;}_{8}^{18}$O | |
| C. | NH4Cl的电子式: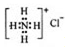 | |
| D. | 邻氯甲苯的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室蒸馏石油时,蒸馏烧瓶中加入一些碎瓷片,为防止暴沸,冷凝管下口进冷水上口出热水 | |
| B. | 实验室制备硝基苯时,将硝酸与苯混合后再滴加浓硫酸 | |
| C. | 实验使手指不小心沾上苯酚,立即用70℃以上的热水清洗 | |
| D. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一点时间后,再与银氨溶液混合加热,观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CH4的电极为负极 | B. | 正极发生氧化反应 | ||
| C. | 溶液中的OH-向负极移动 | D. | 工作一段时间后应补充KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子中核内质子数和核外电子数一定相等 | |
| B. | 溶液稀释前后溶质的质量一定相等 | |
| C. | 常温常压下,酸碱中和反应生成1mol液态水时放出的热量一定相等 | |
| D. | 物质发生化学变化前后,元素的种类一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性Na2CO3>NaHCO3 | |
| B. | 常温下在水中的溶解度Na2CO3>NaHCO3 | |
| C. | 与稀盐酸反应的剧烈程度Na2CO3>NaHCO3 | |
| D. | 等质量的固体与足量盐酸反应放出CO2的质量Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④>⑤ | B. | ③>④>⑤>①>② | C. | ⑤>④>③>②>① | D. | ②>①>⑤>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时HI的分解率20% | B. | 反应起始时固体NH4I是5 mol | ||
| C. | 平衡时,c (NH3)=4.5mol/L | D. | 平衡时HI的分解率10% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油裂解的目的是提高柴油等轻质油的产量和质量 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 煤经气化和液化两个化学变化过程,可变为清洁能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com