
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
A.AlO2— B.Cu2+ C.Al3+ D.Mg2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上第四次月考理化学试卷(解析版) 题型:实验题
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2?2H2O的流程如下:
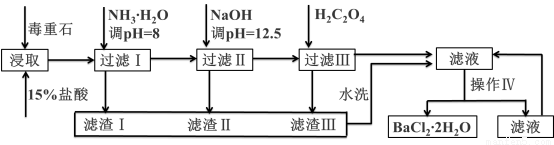
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀的pH | 11.9 | 9.1 | 1.9 |
完全沉淀的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)= 1.6×10–7,Ksp(CaC2O4)= 2.3×10–9
(1)实验室用37%的盐酸配制1mol/L盐酸,除烧杯外,还需要使用下列玻璃仪器中的:______________。
a.容量瓶 b.量筒 c.玻璃棒 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有:_______________________。(至少两条)
(2)加入氨水调节溶液pH=8的目的是:________________________________。滤渣Ⅱ中含__________(填化学式)。加入H2C2O4时应避免过量,原因是:_____________________________。
(3)操作Ⅳ的步骤是:蒸发浓缩、冷却结晶、____________。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H2O Ba2++CrO42—=BaCrO4↓
步骤Ⅰ 移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
氯化钡溶液浓度为______________________ mol·L-1(用含字母的式子表示)。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将___________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建三明一中高一上学期第二次月考化学卷(解析版) 题型:选择题
下列各组中的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.Cu(OH)2+HCl;Cu(OH)2+CH3COOH
B.NaHSO4+NaOH;H2SO4+NaOH
C.NaHCO3+H2SO4;Na2CO3+HCl
D.BaCl2与Na2SO4;Ba(OH)2与CuSO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期中测试化学试卷(解析版) 题型:选择题
向pH相等的一元酸HA和HB溶液中分别加入适量的锌粒,充分反应后,当收集到的H2的体积相等时,消耗酸的体积V(HA)>V(HB),下列分析正确的是
A.消耗锌的质量:HA>HB B.HA一定为强酸
C.生成H2的平均速率:v(HA)< v(HB) D.酸性:HB>HA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上二次月考化学试卷(解析版) 题型:选择题
用CH4催化还原NOx可以消除氮氧化合物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
下列说法中错误的是
A.等物质的量的CH4在反应①、②中转移电子数相同
B.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol
C.4NO2(g)+2N2(g)=8NO(g);△H= +586kJ/mol
D.若用标准状况下4.48L CH4把NO2还原为N2,整个过程中转移的电子总数为1.6NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上期中测试化学试卷(解析版) 题型:选择题
已知最外层电子数相等的元素原子具有相似的化学性质。下列原子中与氧原子化学性质相似 的是
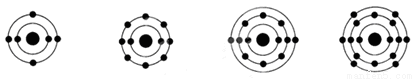
A B C D
查看答案和解析>>
科目:高中化学 来源:2016届云南师大附属中学高三上适应性月考理综化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A、一定条件下反应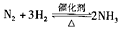 ,达到平衡时,
,达到平衡时,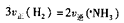
B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能减慢反应这率,又不影响H2的生成
C.将PH=a十l的氨水稀释为pH=a的过程中,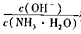 变小
变小
D.常温下,向浓度为0.1 mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高二上12月月考化学卷(解析版) 题型:填空题
根据下面的有机物合成路线回答下列问题:
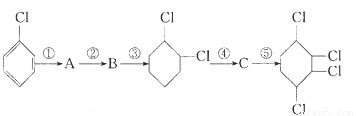
(1)写出A、B、C的结构简式:A:__________,B:__________,C:__________。
(2)各步反应类型:①______,②______,③______;④_______,⑤________。
(3)A→B的反应试剂及条件___________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:填空题
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被为1 mol SO3(g)的ΔH=-99 kJ/mol。

回答下列问题:
(1)图中A、C分别表示:_________________、__________________;E的大小对该反应的反应热有无影响?_______________________;该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_____________;理由是_______________________。
(2)图中ΔH=______________
(3)V2O5的催化物质循环机理可能为:V2O5氧化SO2时,自己被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:___________________。
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(g)生成3 mol SO3(g)的ΔH=____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com