
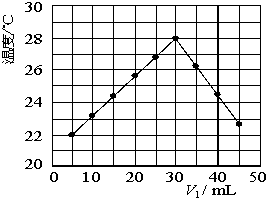
 某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL).回答下列问题:
某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL).回答下列问题:| 3 |
| 2 |
| 3 |
| 2 |
| 100Q |
| 3 |
| 100Q |
| 3 |
| 100Q |
| 3 |
| 100Q |
| 3 |
| Q |
| n |
| V1 |
| V2 |
| 30 |
| 20 |
| 3 |
| 2 |
| c(HCl)×V1 |
| V2 |
| 1.0mol/L×30mL |
| 20mL |
| 3 |
| 2 |
| Q |
| 0.03 |
| 100Q |
| 3 |
| 100Q |
| 3 |
| 100Q |
| 3 |


科目:高中化学 来源: 题型:
 某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:
某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:| 100Q |
| 3 |
| 100Q |
| 3 |
| 100Q |
| 3 |
| 100Q |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度 (填“高于”、
“低于”或“等于”)22 ℃,判断的依据是 。
(2)由题干及图形可知,V1︰V2= 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为 mol/L。
(3)实验时将酸碱在简易量热计中混合,并用 搅拌,使溶液混合均匀。经有关计算知此反应共放出Q kJ的热量,请写出此反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省台州中学高二下学期第一次统练化学试卷(带解析) 题型:实验题
(12分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题: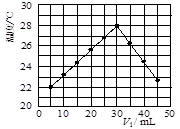
(1)研究小组做该实验时环境温度 (填“高于”、
“低于”或“等于”)22 ℃,判断的依据是 。
(2)由题干及图形可知,V1︰V2= 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为 mol/L。
(3)实验时将酸碱在简易量热计中混合,并用 搅拌,使溶液混合均匀。经有关计算知此反应共放出Q kJ的热量,请写出此反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2010年河北省高三下学期第三次考试(理综)化学部分 题型:实验题
(12分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
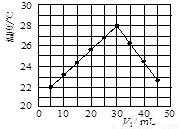
(1)研究小组做该实验时环境温度 (填“高于”、
“低于”或“等于”)22 ℃,判断的依据是 。
(2)由题干及图形可知,V1︰V2= 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为 mol/L。
(3)实验时将酸碱在简易量热计中混合,并用 搅拌,使溶液混合均匀。经有关计算知此反应共放出Q kJ的热量,请写出此反应的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com