
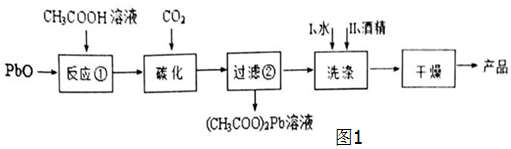
分析 (1)①“反应①”是由PbO和CH3COOH反应生成的(CH3COO)2PbPb(OH)2反应;
②过滤时所需要的玻璃仪器有漏斗、烧杯、玻璃棒;
③用酒精洗涤,以除去表面的水份同时可以快速干燥,得纯净2PbCO3•Pb(OH)2的产品;
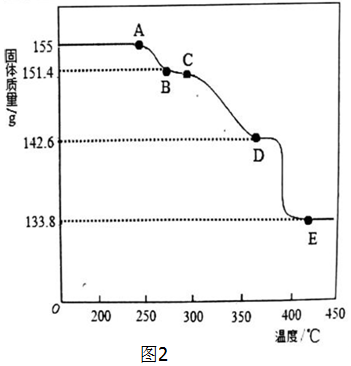
(2)1 mol 2PbCO3•Pb(OH)2(用氧化物形式表示为:3PbO•2CO2•H2O)的质量为775 g,则155 g 2PbCO3•Pb(OH)2的物质的量为0.2 mol,可以表示为:含PbO 0.6 mol、CO2 0.4 mol、H2O 0.2 mol,而加热过程中Pb元素的质量不变,因此
A→B的过程中,△m1=3.6 g,减少的是0.2 mol H2O
B→D的过程中,△m2=8.8 g,减少的是0.2 mol CO2
D→E的过程中,△m3=8.8 g,减少的是0.2 mol CO2
由此计算可得.
解答 解:(1)①“反应①”的生成物是(CH3COO)2PbPb(OH)2,该反应是在90℃、搅拌并保温3h的条件下完成的,则该反应的化学方程式为:2PbO+2CH3COOH$\frac{\underline{\;90℃\;}}{\;}$(CH3COO)2Pb•Pb(OH)2;
故答案为:2PbO+2CH3COOH$\frac{\underline{\;90℃\;}}{\;}$(CH3COO)2Pb•Pb(OH)2;
②过滤时所需要的玻璃仪器有漏斗、烧杯、玻璃棒;
故答案为:烧杯、玻璃棒;
③“洗涤”时,经水洗涤后再用酒精洗涤的目的是除去表面的水份同时可以快速干燥,得纯净2PbCO3•Pb(OH)2的产品;
故答案为:除去沉淀表面附着的水并促进其快速干燥;
(2)①1 mol 2PbCO3•Pb(OH)2(用氧化物形式表示为:3PbO•2CO2•H2O)的质量为775 g
155 g 2PbCO3•Pb(OH)2的物质的量为0.2 mol(1分)
可以表示为:含PbO 0.6 mol、CO2 0.4 mol、H2O 0.2 mol
而加热过程中Pb元素的质量不变,因此
A→B的过程中,△m1=3.6 g,减少的是0.2 mol H2O,B→D的过程中,△m2=8.8 g,减少的是0.2 mol CO2,D→E的过程中,△m3=8.8 g,减少的是0.2 mol CO2,则E点残留的固体为PbO;
故答案为:H2O;PbO;
②1 mol 2PbCO3•Pb(OH)2(用氧化物形式表示为:3PbO•2CO2•H2O)的质量为775 g
155 g 2PbCO3•Pb(OH)2的物质的量为0.2 mol
可以表示为:含PbO 0.6 mol、CO2 0.4 mol、H2O 0.2 mol
而加热过程中Pb元素的质量不变,因此
A→B的过程中,△m1=3.6 g,减少的是0.2 mol H2O
B→D的过程中,△m2=8.8 g,减少的是0.2 mol CO2
D→E的过程中,△m3=8.8 g,减少的是0.2 mol CO2
所以,B点的化学式为2PbCO3•PbO,即3PbO•2CO2
D点的化学式为PbCO3•2PbO,即3PbO•CO2
答:D点残留固体的化学式为PbCO3•2PbO.
点评 本题考查了探究物质组成、测量物质含量及性质实验方案的设计,题目难度中等,注意掌握物质的性质及检验方法,正确分析曲线变化为解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用前要先检查容量瓶是否漏液 | |
| B. | 用蒸馏水洗涤后必须要将容量瓶烘干 | |
| C. | 为了方便快捷,可以直接在容量瓶内进行固体溶解 | |
| D. | 定容结束后,为了使溶液均匀,手握瓶颈,左右振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强不再变化 | B. | X、Y、Z的物质的量之比为2:1:1 | ||
| C. | 混合气体的密度不再变化 | D. | X的分解速率是Y的分解速率的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于漂白纸浆 | B. | SiO2是良好的半导体材料 | ||
| C. | Na2O2可用作潜水艇O2来源 | D. | Cl2可用于消毒和制造漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:1 | B. | 5:1 | C. | 3:1 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ①②③⑦⑧ | D. | ②③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
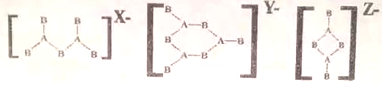
| A. | 4、4、2 | B. | 4、3、2 | C. | 3、3、2 | D. | 4、2、2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 不溶物一定是铜 | |
| B. | 不溶物一定是铁 | |
| C. | 不溶物中一定含铜,但不一定含铁 | |
| D. | 滤液中一定含有FeSO4,一定没有CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(H+):②>① | |
| B. | c(NH4+):③>① | |
| C. | ①和②等体积混合后的溶液:c(H+)=c(OH- )+c(NH3•H2O) | |
| D. | ①和③等体积混合后显碱性,c(NH4+)>c(Cl-)>c(NH3•H2O ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com