

科目:高中化学 来源: 题型:阅读理解
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
| ||
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
| 4 |
| 27 |
| 4 |
| 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
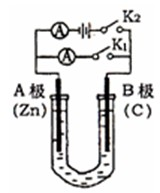 如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江宁波金兰合作组织高二下学期期中联考化学试卷(带解析) 题型:填空题
(12分)如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: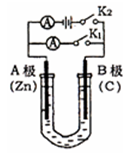
(1)打开K2 ,合并K1,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可观察到的现象是 ,Na+移向 极(填A、B)
②B电极上的电极反应式为 ,总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL,将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,电极反应式是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源:2013届浙江宁波金兰合作组织高二下学期期中联考化学试卷(解析版) 题型:填空题
(12分)如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
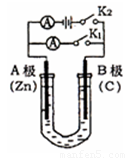
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可观察到的现象是 ,Na+移向 极(填A、B)
②B电极上的电极反应式为 ,总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,电极反应式是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com