
【题目】用图所示实验装置进行相关实验探究,其中装置不合理的是( )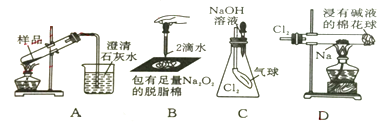
A.A
B.B
C.C
D.D
科目:高中化学 来源: 题型:
【题目】中国科学家屠呦呦因创制新型抗疟药﹣﹣青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( ) 
A.青蒿素的分子式为C15H22O5
B.青蒿素通过还原反应可制得双氢青蒿素
C.青蒿素有青蒿的芳香气味,是芳香族化合物
D.用有机溶剂乙醚从青蒿中提取青蒿素,主要采用萃取的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将BaSO4放入水中不能导电,所以硫酸钡不是电解质
B.NaCl溶液能导电,所以NaCl溶液是电解质
C.氯化氢溶于水能导电,所以盐酸是电解质
D.固态的NaCl不导电,熔融态NaCl可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期主族元素的原子序数依次增大,已知:
①其原子半径大小关系是D>E>B>C>A;
②A、D同主族,B、C、E分处三个连续的主族,且最外层电子数依次增加;
③C是地壳中含量最多的元素,D与C可形成原子个数比为1∶1或2∶1的化合物。
请填写以下空白:
(1)单质B的电子式为____________,结构式为____________。
(2)化合物D2C2的电子式为________________。用电子式表示D2C的形成过程:__________________________。
(3)单质A和单质B在一定条件下发生反应的化学方程式为_________________。
(4)单质E与A、C、D三种元素形成的化合物发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4 , 其流程如下: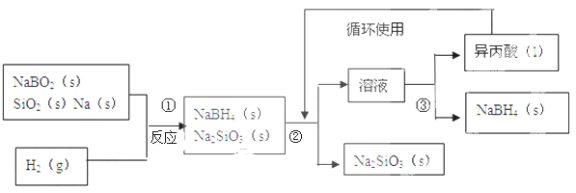
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:33℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是 ,原料中的金属钠通常保存在 中,实验室取用少量金属钠需要用到的实验用品有 , ,玻璃片和小刀等;
(2)请配平第①步反应的化学方程式: NaBO2+ SiO2+ Na+ H2=NaBH4+2Na2SiO3;
(3)第②步分离采用的方法是 ;第③步分离(NaBH4)并回收溶剂,采用的方法是 .
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科学家中,为化学理论做出重大贡献的是
A. 徐光宪(创立稀土萃取理论) B. 屠呦呦(创制新的抗疟疾药)
C. 袁隆平(培育杂交水稻) D. 钱学森
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s)+3H2(g) ![]() W (s) +3H2O (g) 请回答下列问题:
W (s) +3H2O (g) 请回答下列问题:
(1)上述反应的化学平衡常数表达式为。
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为;随着温度的升高,H2与水蒸气的体积比减小,则该反应为反应(填“吸热”或“放热”)。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
温度 | 25 ℃~550 ℃~600 ℃~700 ℃ |
主要成分 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为 ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g) ![]() W(s)+2H2O (g) H=+66.0 kJmol1
W(s)+2H2O (g) H=+66.0 kJmol1
WO2(g)+2H2(g) ![]() W(s)+2H2O (g) H=-137.9 kJmol1
W(s)+2H2O (g) H=-137.9 kJmol1
则WO2(s) ![]() WO2(g)的 H=。
WO2(g)的 H=。
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+ 2 I2 (g) ![]() WI4 (g)。下列说法正确的有。
WI4 (g)。下列说法正确的有。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com