
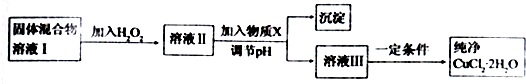
分析 用含FcCl2杂质的CuCl2固体溶解得到混合物溶液Ⅰ,加入过氧化氢氧化亚铁离子为铁离子,溶液Ⅱ中加入试剂不能引入新的杂质,需要加入氧化铜或氢氧化铜或碳酸铜等调节溶液PH使铁离子全部沉淀,过滤得到沉淀为氢氧化铁,溶液Ⅲ为氯化铜溶液,通过蒸发浓缩、冷却结晶、过滤洗涤得到氯化铜晶体,注意蒸发过程中需要防止铜离子的水解,
(1)过氧化氢酸性溶液中氧化亚铁离子为铁离子,结合原子守恒、电子守恒配平书写离子方程式;
(2)溶液Ⅱ中加入试剂不能引入新的杂质,需要加入氧化铜或氢氧化铜或碳酸铜等调节溶液PH使铁离子全部沉淀;
(3)PH试纸使用方法是放在干燥的表面皿中,用玻璃棒蘸取溶液滴在试纸上,依据颜色变化和比色卡对比得到;
(4)亚铁离子具有还原性可以使高锰酸钾溶液褪色,铁离子和KSCN溶液反应生成血红色溶液;
(5)由CuCl2溶液制取CuCl2•2H2O需要防止水解生成氢氧化铜沉淀;
(6)根据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-),Kw=c(H+)•c(OH-)及Fe(OH)3+3H+?Fe3++3H2O的平衡常数表达式,可得3个常数的关系,进行计算.
解答 解:用含FcCl2杂质的CuCl2固体溶解得到混合物溶液Ⅰ,加入过氧化氢氧化亚铁离子为铁离子,溶液Ⅱ中加入试剂不能引入新的杂质,需要加入氧化铜或氢氧化铜或碳酸铜等调节溶液PH使铁离子全部沉淀,过滤得到沉淀为氢氧化铁,溶液Ⅲ为氯化铜溶液,通过蒸发浓缩、冷却结晶、过滤洗涤得到氯化铜晶体,注意蒸发过程中需要防止铜离子的水解,
(1)过氧化氢酸性溶液中氧化亚铁离子为铁离子,结合原子守恒、电子守恒配平书写离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)溶液Ⅱ中加入试剂不能引入新的杂质,需要加入氧化铜或氢氧化铜或碳酸铜等调节溶液PH使铁离子全部沉淀,调节溶液pH所用最佳物质X的化学式为:CuO或Cu(OH)2或CuCO3,
故答案为:CuO或Cu(OH)2或CuCO3 ;
(3)PH试纸使用方法是放在干燥的表面皿中,用玻璃棒蘸取溶液滴在试纸上,依据颜色变化和比色卡对比得到,具体操作步骤为:用洁净干燥的玻璃棒蘸取少量溶液,滴在盛放在表面皿中的PH试纸上,半分钟后与比色卡对照,
故答案为:用洁净干燥的玻璃棒蘸取少量溶液,滴在盛放在表面皿中的PH试纸上,半分钟后与比色卡对照;
(4)亚铁离子具有还原性可以使高锰酸钾溶液褪色,铁离子和KSCN溶液反应生成血红色溶液,分别取溶液Ⅰ少许Ⅰ放入两只试管中,向其中一支试管中滴加少量酸性高锰酸钾溶液,紫红色褪去,证明含有Fe2+,向另一支试管中滴加KSCN溶液,溶液呈血红色,证明含有Fe3+,
故答案为:分别取溶液Ⅰ少许Ⅰ放入两只试管中,向其中一支试管中滴加少量酸性高锰酸钾溶液,紫红色褪去,证明含有Fe2+,向另一支试管中滴加KSCN溶液,溶液呈血红色,证明含有Fe3+;
(5)由CuCl2溶液制取CuCl2•2H2O需要防止水解生成氢氧化铜沉淀,最后由CuCl2溶液制取CuCl2•2H2O的具体操作是应在HCl的氛围中加热蒸发,
故答案为:应在HCl的氛围中加热蒸发;
(6)Fe(OH)3+3H+?Fe3++3H2O的平衡常数表达式k=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$,由Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-),Kw=c(H+)•c(OH-),可知式k=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{Ksp}{K{w}^{3}}$=$\frac{2.79×1{0}^{-39}mo{l}^{4}•{L}^{-4}}{(1×1{0}^{-14})^{3}}$=2790,
故答案为:2790;
点评 本题考查了物质分离提纯的过程、物质除杂的试剂选择、实验基本操作、平衡常数的计算应用等知识点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | 同主族元素的简单阴离子还原性越强,其原子的非金属性越强 | |
| C. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
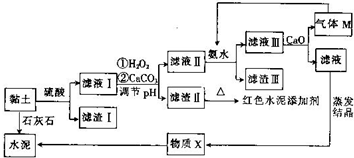 土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.| Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
| 完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
 ;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤<④<③<①<② | B. | ②<①<③<④<⑤ | C. | ⑤<④<②=③<① | D. | ⑤<③<④<②<① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com